
| A. | CH4(g)+2N02(g)═N2(g)+C02(g)+2H2O(l)△H=-867 kJ.mol-1 | |
| B. | CH4催化还原1molNOx为N2的过程中,若x=1.5,则转移的电子总数为3×6.02×1021 | |
| C. | 若0.2 mol CH4还原N02至N2,在上述条件下吸收眵热迸为173.4 kJ | |
| D. | 若用4.48 LCH4还原N02至N2,整个过程中转移电子总数为1.6×6.02×1021 |
分析 A、根据盖斯定律由已知热化学方程式①+②可得2CH4(g)+4NO2(g)=2N2(g)+2CO2(g)+4H2O(g)△H=-1734 kJ•mol-1,由于气态水的能量比液态水的能量高,相同物质的量的甲烷反应生成液态水放出的热量较多;
B、碳元素化合价由CH4中-4价升高为CO2中+4价,据此计算;
C、根据盖斯定律由已知热化学方程式①+②可得目标热化学方程式,然后根据热化学方程式计算放出的热量;
D、标准状况下2.24L CH4的物质的量为0.1mol,碳元素化合价由CH4中-4价升高为CO2中+4价,据此计算.
解答 解:A、已知:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
由盖斯定律①+②可得:2CH4(g)+4NO2(g)=2N2(g)+2CO2(g)+4H2O(g)△H=-1734 kJ•mol-1,即:
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867 kJ•mol-1,由于气态水的能量比液态水的能量高,所以1mol甲烷与2mol二氧化氮反应生成1mol氮气、1mol二氧化碳、2mol液态水放出的热量大于867kJ,故A错误;
B、反应中碳元素化合价由CH4中-4价升高为CO2中+4价,1molCH4催化还原NOx为N2的过程中,若x=1.5,则转移的电子为1mol×[3-(-0)]=3mol,则转移的电子总数为3×6.02×1023,故B正确;
C、由A可知:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867 kJ•mol-1,所以0.2 mol CH4还原NO2至N2,在上述条件下放出的热量为0.2mol×867 kJ•mol-1=173.4 kJ,故C错误;
D、标准状况下2.24L CH4的物质的量为0.1mol,用0.1molCH4还原NO2至N2,反应中碳元素化合价由CH4中-4价升高为CO2中+4价,转移的电子为0.1mol×[4-(-4)]=0.8mol,而状况不知,无法由体积求物质的量,故D错误.
故选:B.
点评 本题考查反应热的计算、盖斯定律、氧化还原反应等,难度中等,注意A中物质的量状态与能量关系,掌握利用盖斯定律构造目标热化学方程式.


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:解答题
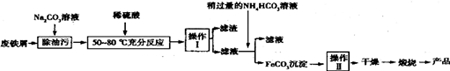
 HCO3-+OH-;
HCO3-+OH-;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
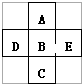 在元素周期表中前四周期的五种元素的位置关系如图所示.若B元素的核电荷数为Z,则五种元素的核电荷数之和为( )
在元素周期表中前四周期的五种元素的位置关系如图所示.若B元素的核电荷数为Z,则五种元素的核电荷数之和为( )| A. | 5Z | B. | 5Z+18 | C. | 5Z+10 | D. | 5Z+8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:9 | B. | 9:1 | C. | 1:11 | D. | 11:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①③⑤ | C. | ①②④ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 11.6g | B. | 15.2g | C. | 18.8g | D. | 21.2g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 自然界硅元素的贮量丰富,并存在大量的单质硅 | |
| B. | 硅可由二氧化硅还原制得 | |
| C. | 二氧化硅晶体--水晶可用于制造光学仪器等 | |
| D. | 生活中常见的硅酸盐材料有玻璃、水泥、陶瓷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验现象 | 解释 |
| A | Cl2和SO2均可使含有酚酞的NaOH溶液褪色 | Cl2和SO2均具有漂白性 |
| B | Fe与稀硝酸、稀硫酸反应均有气泡产生 | Fe与两种酸均发生置换反应 |
| C | 某物质燃烧后的产物既能使白色硫酸铜粉末变蓝,又能使澄清石灰水变浑浊 | 该物质可能是碳氢化合物 |
| D | 向某有机物的水溶液中加Na产生大量气体 | 该有机物中可能含有羟基或羧基 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com