
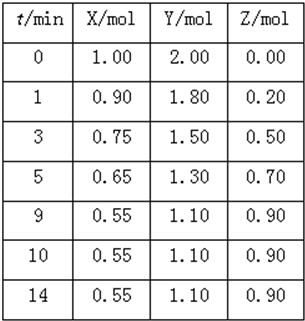
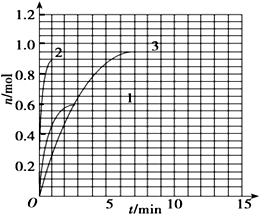
 到Z随时间变化的曲线1、2、3(如图所示)则曲线1所对应的实验条件改变是:
到Z随时间变化的曲线1、2、3(如图所示)则曲线1所对应的实验条件改变是:| X消耗量 |
| X起始量 |
| △c |
| △t |
| ||
| 3min |
| X消耗量 |
| X起始量 |
| 1mol-0.55mol |
| 1mol |


科目:高中化学 来源: 题型:
| 实验目的 | 实验方案 | |
| A | 证明溴乙烷发生消去反应有乙烯生成 | 向试管中加入适量的溴乙烷和NaOH的乙醇溶液,加热,将反应产生的气体通入溴的四氯化碳溶液 |
| B | 证明Mg(OH)2沉淀可以转化为Fe(OH)3沉淀 | 向2mL 1mol/L NaOH溶液中先加入3滴1mol/L MgCl2溶液,再加入3滴1mol/L FeCl3溶液 |
| C | 检验蔗糖的水解产物具有还原性 | 向蔗糖溶液中加入几滴稀硫酸,水浴加热几分钟,向其中加入新制的银氨溶液,并水浴加热 |
| D | 取两只试管,分别加入4mL 0.01mol/L KMnO4酸性溶液,然后向一只试管中加入0.1mol/L H2C2O4溶液2mL,向另一只试管中加入0.2mol/L H2C2O4溶液4mL,记录褪色时间 | 证明草酸浓度越大反应速率越快 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、分子式为C8H10NO2 |
| B、与Br2 1:1加成最多可得2种产物 |
| C、1mol该有机物最多能与3mol H2发生加成反应 |
| D、它的同分异构体中既属于芳香族化合物又属于α-氨基酸的只有1种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、全部 | B、①②④ |
| C、②③④ | D、②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2Na2O2+2Mn2O7=4NaMnO4+O2↑ |
| B、2Na2O2+2N2O3=4NaNO2+O2 |
| C、2Na2O2+2N2O5=4NaNO3+O2↑ |
| D、Na2O2+2NO2=2NaNO3+O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| A、①② | B、②③ | C、③④ | D、①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、燃烧热只针对可燃物和氧气反应而言 |
| B、中和热只针对强酸与强碱反应而言 |
| C、溶解平衡只针对难溶物而言 |
| D、电解池只针对自发进行的氧化还原反应而言 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com