
【题目】氯丁橡胶M是理想的电线电缆材料,工业上可由有机化工原料A或E制得,其合成路线如图所示。
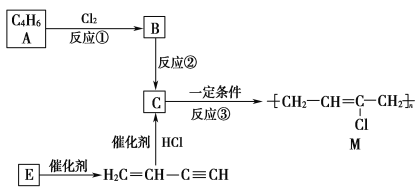
完成下列填空:
(1)A的名称是________________,反应③的反应类型是________。
(2)写出反应②的化学反应方程式:_____________________________________。
(3)为研究物质的芳香性,将E三聚、四聚成环状化合物,写出它们的结构简式:________________________。鉴别这两个环状化合物的试剂为________。
科目:高中化学 来源: 题型:
【题目】一种生物电化学方法脱除水体中NH4+的原理如下图所示:
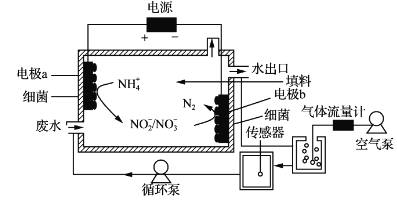
下列说法正确的是
A. 装置工作时,化学能转变为电能
B. 装置工作时,a极周围溶液pH降低
C. 装置内工作温度越高。NH4+脱除率一定越大
D. 电极b上发生的反应之一是:2NO3--2e-=N2↑+3O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1 NaOH溶液在图示的装置中进行中和反应。通过测定反应过程中的热量可计算中和热。回答下列问题:
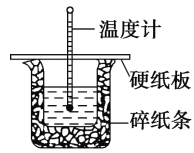
(1)从实验装置上看,图中尚缺少的一种玻璃用品是____________
(2)烧杯间填满碎纸条的作用是__________________________。
(3)大烧杯上如不盖硬纸板,求得的中和热数值____(填“偏大”、“偏小”或“无影响”)。
(4)实验中改用60 mL 0.50 mol·L-1盐酸跟50 mL 0.55 mol·L-1 NaOH溶液进行反应,与上述实验相比,所放出的热量________(填“相等”或“不相等”),所求中和热________(填“相等”或“不相等”)
(5)用50 mL 0.50 mol·L-1 CH3COOH溶液(已知CH3COOH电离时吸热)进行上述实验,测得的中和热的数值会________。(均填“偏大”、“偏小”或“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法正确的是
A.糖类、油脂、蛋白质都属于天然高分子化合物
B.分子式为C2 H6 O、C4 H10的有机物都有2种同分异构体
C.乙烯和苯都能使酸性KMnO4溶液褪色
D.可用热的NaOH溶液除去乙酸乙酯中的乙酸杂质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒(Se)、碲(Te)为VIA族元素,是当今高新技术新材料的主要成分之一,电解精炼铜的阳极泥主要成分为Cu2Te、Ag2Se和少量金属单质及其他化合物,工业上从其中回收碲、硒的一种工艺流程如下:

已知:
I.Se 单质难溶于水。TeO2微溶于水,易溶于较浓的强酸和强碱;
II.元素碲在溶液中主要以Te4+、TeO32-、HTeO3-等形式存在;
III.25℃时,亚碲酸(H2TeO3)的Ka1=1×10-3,Ka2=2×10-8。
(1)Se的氢化物的电子式是_______________。0.1mol/L的H2TeO3电离度(当弱电解质在溶液里达到电离平衡时,溶液中已经电离的电解质分子数占原来总分子数的百分数叫做电离度) 约为_____________________。
(2) 加入浓硫酸焙烧前常将阳极泥中大块颗粒先粉碎,其目的是_______________________。
(3) SeO2 与SO2在冷却后通入水中反应的化学方程式_________________________________。反应后分离出Se单质的操作①为_________________(填操作名称)。
(4)焙砂中碲以TeO2形式存在,与足量NaOH溶液反应后得到的溶液①,其溶质的主要成分为_______(填化学式,过量的NaOH除外)。工业上也可以通过电解溶液①得到单质碲。已知电解时的电极均为石墨,则阴极的电极反应式为__________________________________。
(5)向溶液①中加入硫酸时控制溶液的pH 为4.5~5.0,生成TeO2沉淀,如果H2SO4过量,将导致碲的回收率__________(填“偏高”、“偏低”或“无影响”)。
(6)将纯净的TeO2先溶于盐酸得到四氯化碲,然后再将SO2通入到溶液中得到Te单质,请写出由四氯化碲得到Te单质的离子方程式________________________________。
(7)上述流程中可循环利用的物质_______________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于油脂的说法正确的是( )
A.羧酸与醇形成的酯都是油脂
B.油脂分为油和脂肪,它们是同系物
C.天然油脂都是单甘油酯
D.植物油兼有酯类和烯烃的性质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】糖类、脂肪和蛋白质是维持人体生命活动所必需的三大营养物质,以下叙述不正确的是
A.植物油能使溴的四氯化碳溶液褪色
B.三大营养物质中糖类的热能最高
C.葡萄糖能发生氧化反应但不能发生水解反应
D.蛋白质溶液遇硫酸铜后产生的沉淀不能重新溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】叶酸是维生素系B族之一,可以由下列甲、乙、丙三种物质合成。
甲![]()
乙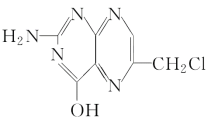
丙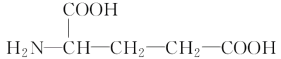
(1)甲中显酸性的官能团是________(填名称)。
(2)下列关于乙的说法正确的是________(填序号)。
a.分子中碳原子与氮原子的个数比是7∶5
b.属于芳香族化合物
c.既能与盐酸又能与氢氧化钠溶液反应
d.属于苯酚的同系物
(3)丁是丙的同分异构体,且满足下列两个条件,丁的结构简式为________。
a.含有![]()
b.在稀硫酸中水解有乙酸生成
(4)甲可以通过下列路线合成(分离方法和其他产物已经略去):
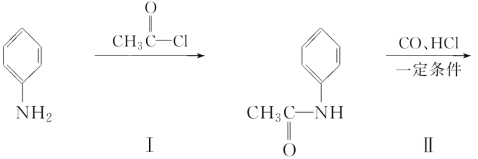

①步骤Ⅰ的反应类型是________。
②步骤Ⅰ和Ⅳ在合成甲过程中的目的是________。
③步骤Ⅳ反应的化学方程式为____________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值。下列有关叙述正确的是( )
A. 5.6g Fe在氧气中燃烧,完全反应时转移电子数为0.3NA
B. 标准状况下,22.4L氦气与22.4L氯气所含原子数均为2NA
C. 标准状况下,18g 水所含电子数目为10NA
D. 1molO2与足量Na反应,生成Na2O和Na2O2的混合物转移的电子数为 2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com