
【题目】向含有KI、NaBr的混合溶液中通入过量的Cl2充分反应。将溶液蒸干并灼烧,最后剩余的固体物质是
A.KI和NaBr B.KCl和NaCl C.KCl和NaBr D.KCl、NaCl和I2
科目:高中化学 来源: 题型:
【题目】下图表示几种无机物之间的转换关系。其中A、B均为黑色粉末,B为非金属单质,C为无色无毒气体,D为金属单质,E是红棕色气体,G是具有漂白性的气体,H的水溶液呈蓝色。
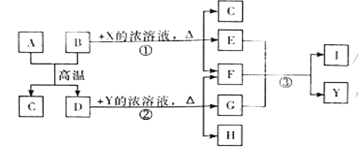
请回答下列问题:
(1)A的化学式是 ,C的电子式是 ,Y的名称是 。
(2)反应1的化学方程式为 。
(3)19.2g的D与足量的一定浓度X的溶液反应,将所得到的气体与 LO2(标准状况下)混合,恰好能被水完全吸收。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】前四周期元素A、B、C、D、E的原子序数依次增大,A的质子数等于周期数,B与C的 P轨道均有三个成单电子,D的最高正价与最低负价代数和为4,E的最外层只有一个电子, 内层轨道处于全充满状态。试回答下列问题。
(1)基态E原子的电子排布式为_________;C和D的第一电离能较大的________(填元素符号)。
(2)DO32-中D原子的杂化类型为_________;A、D和氧元素组成的液态化合物A2DO4中存在的作用力有_____________。
(3)结构式为A—B=B—A的分子中σ键和π键的数目比为________;B2分子和NO+离子互为等离子体,则NO+的电子式为___________。
(4)向EDO4溶液中加入过量稀氨水,其化学方程式为_______________;产物中阳离子的配体是_____________(填化学式)。
(5)D(黑球)和E(白球)形成某种晶体的晶胞如图所示。已知该晶体的晶胞边长为516Pm,则黑球和白球之间最近距离为________pm(精确到0.1,已知![]() =1.732)若ED中D2-被O2-代替,形成的晶体只能采取NaCl型堆积,试从晶体结构分析其不同及原因__________。
=1.732)若ED中D2-被O2-代替,形成的晶体只能采取NaCl型堆积,试从晶体结构分析其不同及原因__________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应一定不能自发的是( )
A.2KClO3(s)═2KCl(s)+3O2(g)
△H=-78.03kJ·mol-1 △S=+1110 J·mol-1·K-1
B.CO(g)═C(s,石墨)+ ![]() O2(g)
O2(g)
△H=+110.5kJ·mol-1 △S=-89.36 J·mol-1·K-1
C.4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s)
△H=-444.3kJ·mol-1 △S=-280.1 J.mol-1·K-1
D.NH4HCO3(s)+CH3COOH(aq)═CO2(g)+CH3COONH4(aq)+H2O(l)
△H=+37.301kJ·mol-1 △S=+184.05 J·mol-1·K-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于电解质溶液的叙述正确的是
A. 常温下,PH=7的NH4Cl与氨水的混合溶液中:c(Cl-)>c(NH4+)>c(H+)=c(OH-)
B. pH=11的NaOH溶液与pH=3醋酸溶液等体积混合,滴入石蕊溶液呈红色
C. 在PH相同的盐酸和氯化铵溶液中水的电离程度相同
D. 向0.1mol/L的氨水中加入少量硫酸铵固体,则溶液中![]() 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某汽车安全气囊的产气药剂主要含有NaN3、Fe2O3、KClO4、NaHCO3等物质。当汽车发生碰撞时,产气药剂产生大量气体使气囊迅速膨胀,从而起到保护作用。
(1)NaN3是气体发生剂,受热分解产生N2和Na,N2的电子式为
(2)Fe2O3是主氧化剂,与Na反应生成的还原产物为 (已知该反应为置换反应).
(3)KClO4是助氧化剂,反应过程中与Na作用生成KCl和Na2O,KClO4含有化学键的类型为 ,K的原子结构示意图为 。
(4)NaHCO3是冷却剂,吸收产气过程中释放的热量而发生分解,其化学方程式为 。
(5)100g上述产气药剂产生的气体通过碱石灰后得到N2 33.6L(标准状况)。
①用碱石灰除去的物质为 ;
②该产气药剂中NaN3的质量分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活、社会密切相关。下列说法中正确的是( )
A. 铅笔芯的原材料为铅,儿童使用铅笔时如果用嘴吮吸能够引起铅中毒
B. “轻轨电车”是一种交通工具,当电车启动时,电车电刷与导线的接触点上由于摩擦会产生高温,因此接触点上的材料应该选用耐高温、能导电的物质,石墨恰好合适
C. 为防止中秋月饼等富含脂质食品氧化变质,常在包装袋中放入生石灰
D. 双氧水是绿色氧化剂,可作医疗消毒剂,说明H2O2对人体无害
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上一般在恒容密闭容器中采用下列反应合成甲醇:
CO(g) +2H2(g) ![]() CH3OH(g) △H =-90.8 kJ·mol-1
CH3OH(g) △H =-90.8 kJ·mol-1
300℃时,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
容器 | 甲 | 乙 | 丙 | |
反应物投入量 | 1 molCO、2 mol H2 | 1mol CH3OH | 2mol CH3OH | |
平衡 时 数据 | CH3OH的浓度(mol·L-1) | c1 | c2 | c3 |
反应的能量变化 | a kJ | bkJ | ckJ | |
体系压强(Pa) | p1 | p2 | p3 | |
反应物转化率 | a1 | a2 | a3 | |
下列说法正确的是
A. 2c1>c3 B. ∣a∣+∣b∣=90.8
C. 2p2<p3 D. a1+ a3<1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com