
【题目】设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
A.23gNa与足量H2O反应完全后可生成NA个H2分子
B.1molCu和足量热浓硫酸反应可生成NA个SO3分子
C.标准状况下,22.4L N2和H2混合气中含NA个原子
D.3mol单质Fe完全转变为Fe3O4 , 失去8NA个电子
科目:高中化学 来源: 题型:
【题目】已知:N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-92.4 kJ·molˉ1。起始反应物为 N2 和 H2物质的量之比为 1︰3,且总物质的量不变,在不同压强和温度下,反应达到平衡时 体系中 NH3 的物质的量分数如下表:
2NH3(g) ΔH=-92.4 kJ·molˉ1。起始反应物为 N2 和 H2物质的量之比为 1︰3,且总物质的量不变,在不同压强和温度下,反应达到平衡时 体系中 NH3 的物质的量分数如下表:
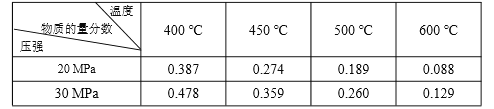
下列说法正确的是
A. 体系中 NH3 的物质的量分数越大,则正反应速率越大
B. 反应达到平衡时,N2 和 H2 的转化率之比均为 1
C. 反应达到平衡时,放出的热量均为 92.4 kJ
D. 600 ℃,30 MPa 下反应达到平衡时,生成 NH3 的物质的量最多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下, m g气体A与n g气体B的分子数相同,下列说法中不正确的是
A. 气体A与气体B的相对分子质量比为m∶n
B. 同质量的气体A与B的分子个数比为n∶m
C. 同温同压下,A气体与B气体的密度比为n∶m
D. 同温同压下,同体积的A气体与B气体的质量比为m∶n
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子一定能在指定溶液中大量共存的是( )
A.使酚酞变红色的溶液中:Na+、Al3+、SO ![]() 、Cl﹣
、Cl﹣
B.![]() =1×10﹣13mol?L﹣1的溶液中:NH4+、Ca2+、Cl﹣、NO3﹣
=1×10﹣13mol?L﹣1的溶液中:NH4+、Ca2+、Cl﹣、NO3﹣
C.与Al反应能放出H2的溶液中:Fe2+、K+、NO ![]() 、SO
、SO ![]()
D.水电离的c(H+)=1×10﹣13mol?L﹣1的溶液中:K+、Na+、AlO2﹣、CO ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将质量相等的铁片和铜片 用导线相连浸入 500mL 硫酸铜溶液中构成如图 1 的装 置:(以下均假设反应过程中溶液体积不变)。

(1)铁片上的电极反应式为___________________________。
(2)若 2 min 后测得铁片和铜片之间的质量差为 1.2g,计算:
①导线中流过的电子的物质的量为_________mo1;
(3)若一段时间后测得铁片减少了 2.4g,同时铜片增加了 3.2g,计算这段时间 内该装置消耗的化学能转化为电能的百分比为_____。
(4)若将该装置改为如图 2 所示的装置也能达到和原装置相同的作用。其中 KCl 溶液起沟通两边溶液形成闭合回路的作用,同时又能阻止反应物直接接触。 则硫酸铜溶液应该注入_________ (填“左侧”、“右侧”或“两侧”)烧杯中。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.白磷有毒因此必须保存在水中,取用时要用镊子
B.纯碱在食品、石油等工业中有着广泛的应用
C.碘是一种重要的药用元素,也是生产含碘食品的必要元素
D.工业上利用氢气和氧气反应来制备盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将5.4 g Al 投入到200.0 mL 2.0 mol·L-1的某溶液中有氢气产生,充分反应后有金属剩余。该溶液可能为
A. HNO3溶液 B. Ba(OH)2溶液 C. H2SO4溶液 D. HCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在101kPa时,1mol纯物质完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热,甲烷的燃烧热是890.3kJmol﹣1 , 则下列热化学方程式书写正确的是( )
A.CH4(g)+ ![]() O2(g)═CO(g)+2H2O(l)△H=﹣890.3kJ?mol﹣1
O2(g)═CO(g)+2H2O(l)△H=﹣890.3kJ?mol﹣1
B.CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=﹣890.3kJ?mol﹣1
C.CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=+890.3kJ?mol﹣1
D.CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=﹣890.3kJ?mol﹣1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com