
【题目】在101kPa时,1mol纯物质完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热,甲烷的燃烧热是890.3kJmol﹣1 , 则下列热化学方程式书写正确的是( )
A.CH4(g)+ ![]() O2(g)═CO(g)+2H2O(l)△H=﹣890.3kJ?mol﹣1
O2(g)═CO(g)+2H2O(l)△H=﹣890.3kJ?mol﹣1
B.CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=﹣890.3kJ?mol﹣1
C.CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=+890.3kJ?mol﹣1
D.CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=﹣890.3kJ?mol﹣1
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
A.23gNa与足量H2O反应完全后可生成NA个H2分子
B.1molCu和足量热浓硫酸反应可生成NA个SO3分子
C.标准状况下,22.4L N2和H2混合气中含NA个原子
D.3mol单质Fe完全转变为Fe3O4 , 失去8NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃与氢气发生反应后能生成(CH3)2CHCH2CH3 , 则该烃不可能是( )
A.2﹣甲基﹣2﹣丁烯
B.2,3﹣二甲基﹣1﹣丁烯
C.3﹣甲基﹣1﹣丁烯
D.2﹣甲基﹣1,3﹣丁二烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用菱锰矿(主要含MnCO3、FeCO3、Al2O3、SiO2)制备MnSO4H2O的工艺流程如下:
Ⅰ.向菱锰矿中加入过量稀H2SO4 , 过滤;
Ⅱ.向滤液中加入过量MnO2 , 过滤;
Ⅲ.调节滤液pH=a,过滤;
Ⅳ.浓缩、结晶、分离、干燥得到产品;
Ⅴ.检验产品纯度.
(1)步骤Ⅰ中,滤渣的主要成分是
(2)将MnO2氧化Fe2+的离子方程式补充完整: MnO2+ Fe 2++ ═ Mn 2++ Fe 3++
(3)与选用Cl2作为氧化剂相比,MnO2的优势主要在于:原料来源广、成本低、可避免环境污染、 .
(4)已知:生成氢氧化物沉淀的pH
Al(OH)3 | Fe(OH)2 | Fe(OH)3 | Mn(OH)2 | |
开始沉淀时 | 3.4 | 6.3 | 1.5 | 7.6 |
完全沉淀时 | 4.7 | 8.3 | 2.8 | 10.2 |
注:金属离子的起始浓度为0.1mol/L
步骤Ⅲ中a的取值范围是 .
(5)步骤Ⅴ,通过测定产品中锰元素的质量分数来判断产品纯度.
已知一定条件下,MnO4﹣与Mn2+反应生成MnO2 . 取x g产品配成溶液,用0.1mol/L KMnO4溶液滴定,消耗KMnO4溶液y mL,产品中锰元素的质量分数为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2005年美国化学会刊报道,美国俄勒冈大学的化学家使用了一种新型催化剂,在常温常压下合成氨,反应可表示为N2+3H2 ![]() 2NH3△H<0,有关说法正确的是( )
2NH3△H<0,有关说法正确的是( )
A.该反应△H<0,△S<0,在任何条件下均可自发进行
B.新法合成氨不需要在高温条件下,可节约大量能源,极具发展远景
C.新法合成氨能在常温下进行是因为不需要断裂化学键
D.使用此新型催化剂能让该反应进行完全
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各溶液中,Na+物质的量浓度最大的是( )
A. 4L、0.5mol/LNaCl溶液 B. 1L、0.3mol/LNa2SO4溶液
C. 5L、0.4mol/LNaOH D. 2L、0.15mol/LNa3PO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(5分)短周期元素X、Y、Z、W核电荷数依次增大,X、Z同主族,Z、W同周期,四种元素的原子序数之和为37,在周期表中X是原子半径最小的元素,Y的最外层电子数是内层电子数的3倍。
(1)W在周期表中的位置是 。
(2)X与Y 能形成具有18个电子的化合物,此化合物的电子式为 。
(3)X、Y、Z三种元素组成的化合物中存在的化学键类型为 。
(4)Z、W两种元素的最高价氧化物对应水化物溶液之间反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产生活密切相关,下列说法不正确的是
A.用食盐、蔗糖等作食品防腐剂
B.用氧化钙作吸氧剂和干燥剂
C.用碳酸钙、碳酸镁和氢氧化铝等作抗酸药
D.用浸泡过高锰酸钾溶液的硅藻土吸收水果产生的乙烯以保鲜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锰酸锂(LiMn2O4)可作为锂离子电池的正极材料.工业上利用软锰矿浆吸收含硫烟气(SO2 和O2)制备锰酸锂,生产流程如图1: 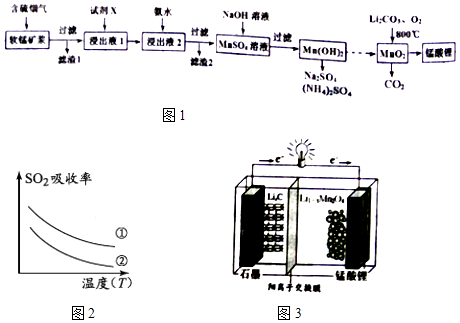
已知:①软锰矿主要成分为MnO2 , 含少量Fe2O3、FeO、Al2O3、SiO2等杂质.
②软锰矿浆在吸收含硫烟气的过程中酸性逐渐增强.
③部分氢氧化物沉淀相关的溶液pH如表一:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 3.4 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 4.7 | 9.8 |
(1)已知:(图2)表二 表二
实验序号 | SO2浓度(gm﹣3) | 烟气流速(mLmin﹣1) |
① | 4.1 | 55 |
② | 4.1 | 96 |
下列措施可提高SO2吸收率的是(填序号)
a.降低通入含硫烟气的温度 b.升高通入含硫烟气的温度
c.减少软锰矿浆的进入量 d.减小通入含硫烟气的流速
(2)加入试剂X能提高产品纯度,则X可以是(填化学式)
(3)加氨水调溶液pH在5~6之间,目的是 .
(4)锰酸锂可充电电池(图3)的总反应式为:Li1﹣xMnO4+LixC ![]() LiMnO4+C(x<1) ①放电时,电池的正极反应式为
LiMnO4+C(x<1) ①放电时,电池的正极反应式为
②充电时,若转移1mole﹣ , 则石墨电极将增重g.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com