
 常温下,将11.65g BaSO4粉末置于盛有250mL蒸馏水的烧杯中,然后向烧杯中加入Na2CO3固体(忽视溶液体积的变化)并充分搅拌,加入Na2CO3固体的过程中,溶液中几种离子的浓度变化曲线如图所示,下列说法中正确的是
常温下,将11.65g BaSO4粉末置于盛有250mL蒸馏水的烧杯中,然后向烧杯中加入Na2CO3固体(忽视溶液体积的变化)并充分搅拌,加入Na2CO3固体的过程中,溶液中几种离子的浓度变化曲线如图所示,下列说法中正确的是| A. | 相同温度时,Ksp(BaSO4)>Ksp(BaCO3) | |
| B. | BaSO4在水中的溶解度、Ksp均比在BaCl2溶液中的大 | |
| C. | 若使0.05molBaSO4全部转化为BaCO3,至少要加入1.25molNa2CO3 | |
| D. | 0.05molBaSO4恰好全部转化为BaCO3时,溶液中离子浓度大小为:c(CO32-)>c(SO42-)>c(OH-)>c(Ba2+) |
分析 A.BaSO4比BaCO3更难溶,二者是同类型物质,可以直接根据溶解性情况比较Ksp大小;
B.BaSO4在BaCl2溶液中由于Ba2+的存在,使沉淀溶解平衡向生成沉淀方向移动,因此在BaCl2溶液中的溶解度不大,Ksp只随温度的改变而改变;
C.11.65g BaSO4粉末,其物质的量为0.05mol,使0.05molBaSO4转化为BaCO3,发生的反应为BaSO4+CO32-?BaCO3+SO42-,根据图象计算二者的Ksp常数,据此判断;
D.0.05molBaSO4恰好全部转化为BaCO3时,溶液中存在SO42-,平衡时CO32-的浓度大于SO42-,CO32-水解促进OH-的形成,因此溶液中浓度最小的是Ba2+,据此判断.
解答 解:A.BaSO4比BaCO3更难溶,二者是同类型物质,可以直接根据溶解性情况比较Ksp大小,因此相同温度时,Ksp(BaSO4)<Ksp(BaCO3),故A错误;
B.BaSO4在BaCl2溶液中由于Ba2+的存在,使沉淀溶解平衡向生成沉淀方向移动,因此在BaCl2溶液中的溶解度不大,Ksp只随温度的改变而改变,无论在水中还是BaCl2溶液中,Ksp值是不变的,故B错误;
C.11.65g BaSO4粉末,其物质的量为0.05mol,使0.05molBaSO4转化为BaCO3,发生的反应为BaSO4+CO32-?BaCO3+SO42-,根据图象,Ksp(BaSO4)=c(Ba2+)c(SO42-)=1.0×10-5×1.0×10-5=1.0×10-10,Ksp(BaCO3)=c(Ba2+)c(CO32-)=1.0×10-5×2.5×10-4=2.5×10-9,反应的平衡常数为K=$\frac{c(S{O}_{4}^{2-})}{c(C{O}_{3}^{2-})}$=$\frac{c(S{O}_{4}^{2-})}{c(C{O}_{3}^{2-})}•\frac{c(B{a}^{2+})}{c(B{a}^{2+})}$=$\frac{{K}_{sp}(BaS{O}_{4})}{{K}_{sp}(BaC{O}_{3})}$=$\frac{1.0×1{0}^{-10}}{2.5×1{0}^{-9}}$=0.04,若使0.05molBaSO4全部转化为BaCO3,则反应生成0.05molSO42-,反应的离子积为Qc=$\frac{c(S{O}_{4}^{2-})}{c(C{O}_{3}^{2-})}=\frac{n(S{O}_{4}^{2-})}{n(C{O}_{3}^{2-})}$=K=0.04,则平衡时n(CO32-)=1.25mol,则至少需要Na2CO3的物质的量为1.25mol+0.05mol=1.3mol,故C错误;
D.0.05molBaSO4恰好全部转化为BaCO3时,溶液中存在大量的SO42-,平衡时CO32-的浓度大于SO42-,CO32-水解促进OH-的形成,因此溶液中浓度最小的是Ba2+,因此离子浓度大小关系为:c(CO32-)>c(SO42-)>c(OH-)>c(Ba2+),故D正确.
故选D.
点评 本题考查沉淀溶解平衡知识,同类型物质可直接根据Ksp数值比较溶解性情况,C项为易错点,需注意根据平衡常数计算的是平衡浓度,不是反应的起始浓度,计算初始浓度还需算上转化的浓度,本题难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 氨水的电离程度 | B. | $\frac{c(N{H}_{3}•{H}_{2}O)}{c(O{H}^{-})}$ | C. | c(H+)和c(OH-)的乘积 | D. | OH-的物质的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由于碘在酒精中的溶解度大,所以可用酒精将碘水中的碘萃取出来 | |
| B. | 由于胶体微粒的直径比离子大,所以碘化钾混入淀粉中可用渗析法分离 | |
| C. | 可用冷却热的饱和氯化钾和氯化钠混合溶液的方法得到纯净的氯化钠晶体 | |
| D. | 水的沸点是100℃,酒精的沸点是78.5℃,所以可用直接加热蒸馏法使含水酒精变为无水酒精 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| Y | Z | M | |
| W |
| A. | 原子半径:W>Y>Z>M>X | |
| B. | N的一种氧化物可用作油漆和涂料 | |
| C. | 氢化物的沸点:Z大于M | |
| D. | 工业上制备W单质的方法为电解熔融的W的氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单氢化物的沸点:Y>R | |
| B. | 原子半径的大小顺序:Z>R>X>Y | |
| C. | 氧化物对应的水化物的酸性:R>X | |
| D. | 只含有Y、Z、R三种元素的化合物一定既含离子键又含共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 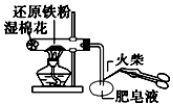 验铁粉与水蒸气反应产生的氢气 | |
| B. |  分离两种互溶但沸点相差较大的液体混合物 | |
| C. |  乙酸乙酯的制备演示实验 | |
| D. |  碳酸氢钠受热分解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等浓度的Na2CO3、NaHCO3溶液混合后:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) | |
| B. | 0.1 mol•L-1的氨水与0.05 mol•L-1的 H2SO4溶液等体积混合后所得溶液中:2c(NH4+)+2c(NH3•H2O)═c(SO42-) | |
| C. | Kb(NH3•H2O)=2×10-5 mol•L-1,25℃时;将m mol NH4NO3固体加入氨水得n L中性溶液,所滴加氨水的浓度约为m/(200n)mol•L-1 | |
| D. | 向0.10mol•L-1CH3COONa溶液中通入HCl至PH=4:c(CH3COOH)>c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 如图1,向容量瓶中转移溶液 | |
| B. | 图2,用标准浓度的NaOH溶液滴定未知浓度的盐酸 | |
| C. | 图3,实验室用浓硫酸和乙醇共热制乙烯 | |
| D. | 图4,验证H2在Cl2中燃烧的实验现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com