
【题目】海洋是生命的摇篮,海水不仅是宝贵的水资源,而且蕴藏着丰富的化学资源。从海水中提取一些重要的化工产品的工艺流程如图所示。

根据上述流程图回答下列问题:
(1)海水淡化处理的方法有蒸馏法、冷冻法、_____________。(写出1种即可)
(2)写出反应①化学反应方程式_______________________________________。
(3)标准状况下22.4 L Cl2气体发生反应②,转移的电子数是________NA。
(4)反应③中硫酸酸化可提高Cl2的利用率,理由是____________________________。
(5)过程③到过程⑤的变化为“Br-→Br2→Br-→Br2”,其目的是_______________。
(6)浓缩氯化镁溶液后冷却可以得到MgCl2﹒6H2O,该晶体受热时会发生如下变化:MgCl2﹒6H2O== Mg(OH)Cl + HCl↑+ 5H2O。则,从溶液制备无水晶体的“操作a”可以采取的措施是__________________________________________。
【答案】 离子交换膜法(也可写成电渗析法或反渗析法) 2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑ 1 酸化可抑制氯气、溴与水反应 富集溴 将MgCl2溶液在HCl气流中蒸干
2NaOH+H2↑+Cl2↑ 1 酸化可抑制氯气、溴与水反应 富集溴 将MgCl2溶液在HCl气流中蒸干
【解析】(1)海水淡化处理的方法有蒸馏法、冷冻法、离子交换膜法、电渗析法或反渗析法等;(2)反应①是电解饱和食盐水生成氢氧化钠、氢气和氯气,其反应化学反应方程式为:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑;(3)标准状况下22.4 L Cl2气体发生反应②:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,转移的电子数是NA;(4)反应③中硫酸酸化,抑制氯气、溴与水反应,可提高Cl2的利用率;(5)过程③到过程⑤的变化为“Br-→Br2→Br-→Br2”,其目的是:富集溴;(6)浓缩氯化镁溶液后冷却可以得到MgCl2﹒6H2O,该晶体受热时会发生如下变化:MgCl2﹒6H2O== Mg(OH)Cl + HCl↑+ 5H2O。则,从溶液制备无水晶体的“操作a”可以采取的措施是:将MgCl2溶液在HCl气流中蒸干,避免氯化镁水解而得不到无水晶体。
2NaOH+H2↑+Cl2↑;(3)标准状况下22.4 L Cl2气体发生反应②:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,转移的电子数是NA;(4)反应③中硫酸酸化,抑制氯气、溴与水反应,可提高Cl2的利用率;(5)过程③到过程⑤的变化为“Br-→Br2→Br-→Br2”,其目的是:富集溴;(6)浓缩氯化镁溶液后冷却可以得到MgCl2﹒6H2O,该晶体受热时会发生如下变化:MgCl2﹒6H2O== Mg(OH)Cl + HCl↑+ 5H2O。则,从溶液制备无水晶体的“操作a”可以采取的措施是:将MgCl2溶液在HCl气流中蒸干,避免氯化镁水解而得不到无水晶体。


科目:高中化学 来源: 题型:
【题目】下列实验现象与新制氯水中的某些成分(括号内物质)没有关系的是( )
A. 将NaHCO3固体加入新制氯水中,有无色气泡(H+)
B. 新制氯水呈黄绿色(Cl2)
C. 使蓝色石蕊试纸先变红后褪色(H+、Cl2)
D. 滴加AgNO3溶液生成白色沉淀(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将CO2通入下列物质的溶液中不与其反应的是( )
①Na2CO3 ②Ca(ClO)2 ③CaCO3 ④CaCl2
A. ①③④ B. ①和③ C. 只有② D. 只有④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产和生活密切相关。下列有关说法正确的是
A. 硅太阳能电池利用的是原电池原理 B. 草木灰与硝酸铵混成复合肥施用
C. 硅胶可用作瓶装药品的干燥剂 D. 用于发酵的小苏打属于碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组比较不正确的是( )
A. 锂与水反应不如钠与水反应剧烈
B. 还原性:K>Na>Li,故K可以从NaCl溶液中置换出金属钠
C. 熔、沸点:Li>Na>K
D. 碱性:LiOH<NaOH<KOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有H2、Cl2混合气100mL(标况),其中一种气体体积为45mL。光照使两种气体发生反应后恢复到标况,气体体积为______mL。为了说明反应后气体中H2或Cl2有剩余,使气体通过10mL水,并使剩余气体干燥后恢复到标况,若(1)剩余________mL,证明有________剩余;理由___________________。
(2)溶液有________性质,证明有________剩余;理由是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前,世界上生产的镁有60%来自海水,其生产流程图如下

(1)贝壳的主要化学成分为________________(写化学式).
(2)写出反应②的离子方程式:_____________.
(3)根据流程图可知,可循环利用的物质是________________.
(4)Mg与CO2反应时,有白色粉末并有黑色固体生成.请写出Mg与CO2反应的化学方程式,并用单线桥标出电子转移的方向与数目.___________________.
(5)Na比Mg和Al要活泼.将Na投入到Fe2(SO4)3溶液中会发生剧烈的化学反应,其离子方程式为__________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
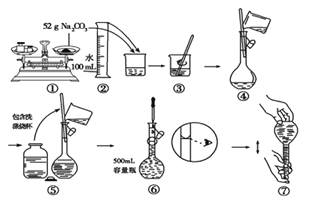
【题目】I、某同学用Na2CO3配制500mL 1.0mol/L Na2CO3溶液的过程如图所示(第⑤步小口瓶中为蒸馏水)。你认为该同学配制溶液的明显错误有(填实验步骤的序号)_______, 所配溶液的浓度(填“低于”、“等于”或“高于”)________ 1.0mol/L。
Ⅱ、一化学兴趣小组,探究从某工业废水(含有大量的FeSO4、较多的Cu2+和少量的Na+)中回收FeSO4制备绿矾(FeSO4·7H2O),同时回收金属铜的方法,以减少污染并交废为宝。以下是他们设计出的回收流程图,回答有关问题。
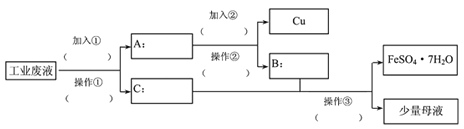
(1)加入的①为(填物质名称)_________,加入②后的离子反应为________。
(2)操作②的名称为_____________。
(3)操作③为蒸发浓缩,降温结晶,过滤,用50%的酒精溶液洗涤绿矾晶体。洗涤FeSO4·7H2O晶体时,用50%的酒精洗涤而未用蒸馏水洗涤的原因是_____________。
(4)母液中含有的离子有(填离子符号): _____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在溶液中能够大量共存的是
A、NH4+、NO3-、Na+、SO42- B、H+、Fe2+、Na+、NO3-
C、 Ba2+、K+、Al3+、HCO3- D、NH4+、Li+、OH-、SO42-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com