
【题目】锌溴液流电池是一种新型电化学储能装置(如下图所示),电解液为溴化锌水溶液,电解液在电解质储罐和电池间不断循环。下列说法正确的是( )
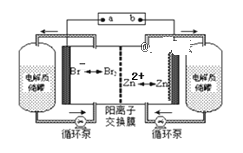
A. 充电时阴极的电极反应式为:Br2+2e-=2Br-
B. 放电时每转移2mol电子,负极区质量减少65克
C. 放电时左侧电解质储罐中的离子总浓度增大
D. 充电是b接电源的正极,Zn2+通过阳离子交换膜由左侧流向右侧
【答案】C
【解析】
在充电时,是电能转化为了化学能,相当于是电解池。而在放电时,是化学能转化为电能,相当于是原电池。原电池的正极,连接电解池的阳极,而电解池的阳极连接电源的正极,在电解池中,阴离子向阳极移动,由溴离子向左边移动可知,a应连接原电池的正极,b应连接原电池的负极,据此答题。
A.充电时阴极的电极反应式为:Zn2++2e﹣=Zn,故A错误;
B.放电时负极的电极反应式为:Zn-2e-=Zn2+,Zn2+通过阳离子交换膜由右侧流向左侧,2mol电子与1mol锌离子所带电量相同,故B错误;
C.放电时,右侧生成的锌离子移向左侧,左侧溴单质发生得电子的还原反应生成溴离子,所以左侧电解质储罐中的离子总浓度增大,故C正确;
D.充电是b接电源的负极,Zn2+通过阳离子交换膜由左侧流向右侧,故D错误。
故选C。


 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案科目:高中化学 来源: 题型:
【题目】下列关于硅与氢氧化钠溶液反应(Si+2NaOH+H2O=Na2SiO3+2H2↑)的说法正确的是( )
A.氧化剂是NaOH和H2OB.氧化剂是H2O
C.氧化剂是SiD.还原剂是H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语正确的是
A. HSO3-+ H2O![]() SO32- + OH- B. Al3+ + 3H2O == 3H+ + Al(OH)3↓
SO32- + OH- B. Al3+ + 3H2O == 3H+ + Al(OH)3↓
C. NaHCO3 == Na+ + HCO3- D. H2S![]() 2H+ + S2-
2H+ + S2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1000mol/L NaOH溶液滴定20.00mL 0.1000mol/L HCl溶液,滴定曲线如图所示,下列说法不正确的是
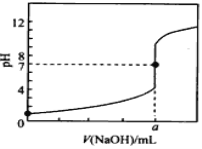
A. a=20.00
B. 滴定过程中,可能存在:c(Cl-)>c(H+)>c(Na+)>c(OH-)
C. 若将盐酸换成相同浓度的醋酸,则滴定到pH=7时,a<20.00
D. 若用酚酞作指示剂,当滴定到溶液明显由无色变为浅红色时立即停止滴定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物X的结构简式如图所示,下列有关说法不正确的是
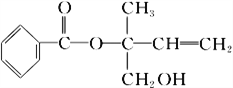
A. X分子中含有三种官能团
B. 可用酸性高锰酸钾溶液区别苯和X
C. X在一定条件下能发生加成、加聚、取代、氧化等反应
D. 在催化剂的作用下,1 mol X最多能与5 mol H2加成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如下:

(1)反应Ⅰ:2H2SO4(l)=2SO2(g)+O2(g)+2H2O(g) ΔH=+550 kJ·mol-1
它由两步反应组成:i. H2SO4(l)=SO3(g)+H2O(g) ΔH=+177 kJ·mol-1 ii. SO3(g)分解。
L(L1、L2)、X可分别代表压强和温度。下图表示L一定时,ii中SO3(g)的平衡转化率随X的变化关系。

① X代表的物理量是_____________________。
② 判断L1、L2的大小关系是______________。
(2)反应Ⅱ:I-可以作为催化剂,可能的催化过程如下。
i. SO2+4I-+4H+=S↓+2I2+2H2O; ii. I2+2H2O+ SO2= SO42-+4H++2I-;
探究i、ii反应速率与SO2歧化反应速率的关系,实验如下:分别将18 mL SO2饱和溶液加入到2 mL下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中)
序号 | A | B | C | D |
试剂组成 | 0.4 mol/L KI | a mol/LKI 0.2 mol/LH2SO4 | 0.2 mol/L H2SO4 | 0.2 mol/L KI 0.0002 mol I2 |
实验现象 | 溶液变黄,一段时间后出现浑浊 | 溶液变黄,出现浑浊较A快 | 无明显现象 | 溶液由棕褐色很快褪色,变成黄色,出现浑浊较A快 |
① B是A的对比实验,则a=__________。
② 比较A、B、C,可得出的结论是_______________________________。
③ 实验表明,SO2的歧化反应速率D>A,结合i、ii反应速率解释原因:___________。
(3)在钠碱循环法中,Na2SO3溶液作为吸收液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
n(SO32-):n(HSO3-) | 91:9 | 1:1 | 1:91 |
pH | 8.2 | 7.2 | 6.2 |
当吸收液的pH降至约为6时,需送至电解槽再生。再生示意图如下:

① 上表判断NaHSO3溶液显__________性,用化学平衡原理解释:_____________。
② HSO3-在阳极放电的电极反应式是______,当阴极室中溶液pH升至8以上时,吸收液再生并循环利用。简述再生原理________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在溶液中有浓度均为0.01mol·L﹣1的Fe3+、Cr3+、Zn2+、Mg2+等离子,已知:25℃时,Ksp=4.0×10﹣38;Ksp=7.0×10﹣31,Ksp=1.0×10﹣17;Ksp=1.8×10﹣11.当其氢氧化物刚开始沉淀时,下列哪一种离子所需的pH最小( )
A. Fe3+ B. Cr3+
C. Zn2+ D. Mg2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com