
【题目】下列有关硅和二氧化硅的用途错误的是( )
A.硅单质作耐火材料B.晶体硅作半导体材料
C.二氧化硅作光导纤维材料D.高纯硅作计算机芯片材料
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
【题目】在25℃、101 kPa下,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ,下列热化学方程式正确的是( )
A. CH3OH(l)+![]() O2(g)===CO2(g)+2H2O(l);ΔH=" +725.8" kJ/mol
O2(g)===CO2(g)+2H2O(l);ΔH=" +725.8" kJ/mol
B. 2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l);ΔH= -1452 kJ/mol
C. 2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l);ΔH= -725.8 kJ/mol
D. 2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l);ΔH=" +1452" kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上采用化学沉降法处理酸性高浓度含砷废水(砷主要以亚砷酸H3AsO3形式存在),同时从沉渣中还可以提取出常用的中药药剂As2O3,基本实现了废水处理过程的“三废”零排放。工艺流如下:

回答下列问题:
(1)H3AsO3中,砷元素的化合价为__________
(2)H3AsO3是三元弱酸,第一步和第二步电离是通过和水中的OH-结合实现的,第三步则直接电离出H+,第一步电离方程式为H3AsO3+H2O![]() [As(OH)4]-+H+,则第二步电离方程式为________________________________。
[As(OH)4]-+H+,则第二步电离方程式为________________________________。
(3)已知:As2S3与过量的S2-存在以下反应:As2S3(s)+3S2-(aq) ![]() 2AsS33-(aq); “一级沉砷”中FeSO4的作用是___________________________________________________
2AsS33-(aq); “一级沉砷”中FeSO4的作用是___________________________________________________
(4)“二级沉砷”后,滤渣A的主要成分,除含有Ca3(AsO4)2 、FeAsO4、Fe(OH)3外,还有________(写化学式)。
(5)写出Ⅳ过程中,由Na3AsO4制备As2O3 的离子方程式 ____________________________ 。
(6)砷酸(H3AsO4)分步电离的平衡常数(25℃)为:K1=5.6×10-3 , K2=1.7×10-7 , K3=4.0×10-12, Na3AsO4的第一步水解的离子方程式为:AsO43-+H2O![]() HAsO42-+OH-,该步水解的平衡常数(25℃)为__________(保留两位有效数字)。
HAsO42-+OH-,该步水解的平衡常数(25℃)为__________(保留两位有效数字)。
(7)雌黄(As2S3)和雄黄(As4S4 )是自然界中常见的砷化物,一定条件下,两者的转化关系如下图所示。若反应Ⅱ中,1mol As4S4(其中As元素的化合价为+2价)参加反应时,转移28mole-,则物质a为_________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 反应A(g)+3B(g)![]() 2C(g)+2D(g),在四种不同情况下用不同物质表示的反应速率
2C(g)+2D(g),在四种不同情况下用不同物质表示的反应速率
分别如下,其中反应速率最大的是( )
A.v(C)=0.04 mol/(L·s)
B.v(B)=0.06 mol/(L·min)
C.v(A)=0.15 mol/(L·min)
D.v(D)=0.01 mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按要求回答下列问题:
(1)在2L密闭容器内,800℃时反应2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如下表:
2NO2(g)体系中,n(NO)随时间的变化如下表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
①如图中,表示NO2变化曲线的是_______ 。用O2表示从0s ~2s内该反应的平均速率V=__________。
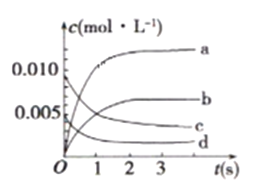
②能说明该反应已达到平衡状态的是___________
A.v(NO2)=2v(O2) B.容器内压强保持不变
C.容器中氧气体积分数不变 D.容器内密度保持不变
(2)为了探究铝电极在原电池中的作用,设计并进行了以下一系列实验,试完成有关问题:
实验编号 | 电极材料 | 电解质溶液 |
1 | Al、Mg | 稀盐酸 |
2 | Al、Cu | 稀盐酸 |
3 | Al、C(石墨) | 稀盐酸 |
4 | Al、 | 氢氧化钠溶液 |
5 | Al、Zn | 浓硝酸 |
①实验1中Al所作的电极是______(填“正极”或“负极”)。
②实验2中H+移向______(填“Al”或“Cu”),Cu极发生_____反应(填“氧化”或“还原”)。
③实验3中石墨的电极反应式: _________________。
④实验4中铝作______极,写出总反应的化学方程式:_______________________。
⑤实验5中负极的电极反应式为:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌溴液流电池是一种新型电化学储能装置(如下图所示),电解液为溴化锌水溶液,电解液在电解质储罐和电池间不断循环。下列说法正确的是( )
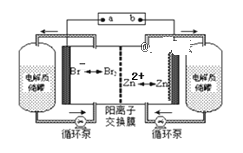
A. 充电时阴极的电极反应式为:Br2+2e-=2Br-
B. 放电时每转移2mol电子,负极区质量减少65克
C. 放电时左侧电解质储罐中的离子总浓度增大
D. 充电是b接电源的正极,Zn2+通过阳离子交换膜由左侧流向右侧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界中的许多植物中含有醛,其中有些具有特殊香味,可作为植物香料使用,例如桂皮含肉桂醛(![]() ),杏仁含苯甲醛(
),杏仁含苯甲醛(![]() )。下列说法错误的是
)。下列说法错误的是
A. 肉桂醛能发生加成反应、取代反应和加聚反应
B. 可用新制氢氧化铜悬浊液检验肉桂醛分子中的含氧官能团
C. 肉桂醛和苯甲醛互为同系物
D. 苯甲醛分子中所有原子可能位于同一平面内
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知乙烯能发生以下转化:

(1)乙烯的结构式为:_________________。
(2)写出下列化合物官能团的名称:
B中含官能团名称________________;
D中含官能团名称________________。
(3)写出反应的化学方程式及反应类型:
①__________________;反应类型:________。
②__________________;反应类型:________。
③__________________;反应类型:________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com