
【题目】在25℃、101 kPa下,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ,下列热化学方程式正确的是( )
A. CH3OH(l)+![]() O2(g)===CO2(g)+2H2O(l);ΔH=" +725.8" kJ/mol
O2(g)===CO2(g)+2H2O(l);ΔH=" +725.8" kJ/mol
B. 2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l);ΔH= -1452 kJ/mol
C. 2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l);ΔH= -725.8 kJ/mol
D. 2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l);ΔH=" +1452" kJ/mol
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】黄铜矿(主要成分为CuFeS2)是生产铜、铁和硫酸的原料。回答下列问题:
(1)基态Cu原子的价电子排布式为________
(2)从原子结构角度分析,第一电离能I1(Fe)与I1(Cu)的关系是:I1(Fe)____I1(Cu)(填“>“<"或“=”)
(3)血红素是吡咯(C4H5N)的重要衍生物,血红素(含Fe2+)可用于治疗缺铁性贫血。吡略和血红素的结构如下图:
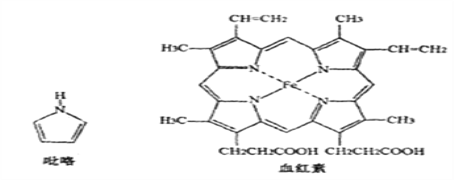
①已知吡咯中的各个原子均在同一平面内,则吡咯分子中N原子的杂化类型为_______
②1mol吡咯分子中所含的σ键总数为____个。分子中的大π键可用![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则吡略环中的大π键应表示为_____。
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则吡略环中的大π键应表示为_____。
③C、N、O三种元素的简单氢化物中,沸点由低到高的顺序为________(填化学式)。
④血液中的O2是由血红素在人体内形成的血红蛋白来输送的,则血红蛋白中的Fe2+与O2是通过_____键相结合。
(4)黄铜矿冶炼铜时产生的SO2可经过SO2![]() SO3
SO3![]() H2SO4途径形成酸雨。SO2的空间构 型为________。H2SO4的酸性强于H2SO3的原因是____________
H2SO4途径形成酸雨。SO2的空间构 型为________。H2SO4的酸性强于H2SO3的原因是____________
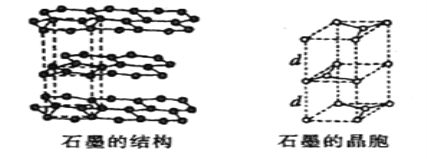
(5)用石墨作电极处理黄铜矿可制得硫酸铜溶液和单质硫。石墨的晶体结构如下图所示,虚线勾勒出的是其晶胞。则石墨晶胞中含碳原子数为____个。已知石墨的密度为ρg/cm3,C-C键的键长为rcm,设阿伏加德罗常数的值为NA,则石墨晶体的层间距d=______cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子结构模型的演变图中,①为道尔顿实心球式原子模型、②为卢瑟福带核的原子模型、③为汤姆生葡萄干面包式原子模型、④为玻尔轨道式原子模型。其中符合历史演变顺序的一组排列是( )

① ② ③ ④
A. ①③②④ B. ①②③④
C. ①④③② D. ①③④②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法不正确的是
A. 32 g S8(分子结构:![]() )中的共价键数目为NA
)中的共价键数目为NA
B. 2 g由H218O和2H2O组成的物质中含有的质子数为NA
C. 14 g乙烯和丙烯的混合物完全燃烧时,产生的CO2分子数目为NA
D. 15 g 甲基中所含的电子数为10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以软锰矿(主要成分为MnO2) 为主要原料制备高锰酸钾(KMnO4)的工艺流程如下:
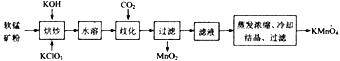
回答下列问题:
(1)原料软锰矿在使用之前通常需粉碎,其目的是_________________________________。
(2)“烘炒”时是将混合物放入某种材质的坩埚内,混合均匀,小火加热至熔融,有K2MnO4和KCl生成,则烘炒过程中发生反应的化学方程式为________________;“烘炒”时所用坩埚的材质可以选用_______(填字母)。
a.石英 b.氧化铝 c.硅酸盐陶瓷 d.铁
(3)已知水溶过程中无化学反应发生,通入CO2使反应体系呈中性或弱酸性即可发生歧化反应,则歧化时发生反应的氧化产物与还原产物的物质的量之比为_______________。
(4)对滤液进行蒸发浓缩时,温度不宜超过60℃,其原因是_________________;将蒸发温度控制在60℃左右的最佳操作方法是_______________________。
(5)流程中可以循环利用的物质是___________________。
(6)用CO2歧化法将K2MnO4转化为KMnO4属于传统工艺,现代工艺多采用电解法,即电解K2MnO4水溶液,电解槽中阳极发生的电极反应为_________________;与“CO2歧化法”相比,“电解法”的显著优点是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】糖类、脂肪和蛋白质是维持人体生命活动必需的三大营养物质。下列说法错误的是
A.纤维素、淀粉、油脂、蛋白质都是高分子化合物
B.淀粉水解的最终产物能发生银镜反应
C.人体不具备水解纤维素的能力,但可以水解淀粉
D.油脂能发生皂化反应,生成甘油和高级脂肪酸钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I(化学反应原理)
甲、乙两池电极材料都是铁棒与碳棒如图。若两池中均盛放氯化钠溶液,反应一段时间后,请回答下列问题:

(1)甲池中铁作______极,乙池中铁作_______极。
(2)甲池中铁电极反应__________________,碳电极反应________________。
(3)乙池中总反应化学方程式__________________。
II(化学与生活)
材料与生活、生产息息相关,目前使用的材料主要有:金属材料、传统无机非金属材料、新型无机非金属材料、高分子材料、复合材料等。
(1)硅酸盐材料是重要的传统无机非金尾材料,也是日常生活、交通工具、建筑行业等不可缺少的材料之一。下列不属于硅酸盐产品的是___________(填写序号)
①光导纤维 ②水泥 ③玻璃 ④陶瓷
(2)玻璃是重要的建筑和装饰材料,玻璃属于______(填“纯净物”或“混合物”)。有些玻璃的花纹是利用氢氟酸对普通玻璃中的二氧化硅的腐蚀作用而制成的,写出该反应的化学方程式______。
(3)氮化硅是一种高温陶瓷材料,它的硬度大、熔点高,化学性质稳定。工业上普遍采用高纯硅与纯氮在1300℃反应获得氮化硅,该反应属于化学反应基本类型中的_____反应;已知氮化硅中硅元素的化合价为+4价,则氮化硅的化学式为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com