
ЁОЬтФПЁПЙЄвЕЩЯвдШэУЬПѓ(жївЊГЩЗжЮЊMnO2) ЮЊжївЊдСЯжЦБИИпУЬЫсМи(KMnO4)ЕФЙЄвеСїГЬШчЯТЃК
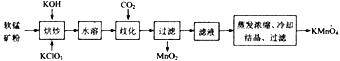
ЛиД№ЯТСаЮЪЬтЃК
(1)дСЯШэУЬПѓдкЪЙгУжЎЧАЭЈГЃашЗлЫщЃЌЦфФПЕФЪЧ_________________________________ЁЃ
(2)ЁАКцГДЁБЪБЪЧНЋЛьКЯЮяЗХШыФГжжВФжЪЕФлсліФкЃЌЛьКЯОљдШЃЌаЁЛ№МгШШжСШлШкЃЌгаK2MnO4КЭKClЩњГЩЃЌдђКцГДЙ§ГЬжаЗЂЩњЗДгІЕФЛЏбЇЗНГЬЪНЮЊ________________ЃЛЁАКцГДЁБЪБЫљгУлсліЕФВФжЪПЩвдбЁгУ_______(ЬюзжФИ)ЁЃ
aЃЎЪЏгЂ bЃЎбѕЛЏТС cЃЎЙшЫсбЮЬеДЩ dЃЎЬњ
(3)вбжЊЫЎШмЙ§ГЬжаЮоЛЏбЇЗДгІЗЂЩњЃЌЭЈШыCO2ЪЙЗДгІЬхЯЕГЪжаадЛђШѕЫсадМДПЩЗЂЩњЦчЛЏЗДгІЃЌдђЦчЛЏЪБЗЂЩњЗДгІЕФбѕЛЏВњЮягыЛЙдВњЮяЕФЮяжЪЕФСПжЎБШЮЊ_______________ЁЃ
(4)ЖдТЫвКНјааеєЗЂХЈЫѕЪБЃЌЮТЖШВЛвЫГЌЙ§60Ёц,ЦфдвђЪЧ_________________ЃЛНЋеєЗЂЮТЖШПижЦдк60ЁцзѓгвЕФзюМбВйзїЗНЗЈЪЧ_______________________ЁЃ
(5)СїГЬжаПЩвдбЛЗРћгУЕФЮяжЪЪЧ___________________ЁЃ
(6)гУCO2ЦчЛЏЗЈНЋK2MnO4зЊЛЏЮЊKMnO4ЪєгкДЋЭГЙЄвеЃЌЯжДњЙЄвеЖрВЩгУЕчНтЗЈЃЌМДЕчНтK2MnO4ЫЎШмвКЃЌЕчНтВлжабєМЋЗЂЩњЕФЕчМЋЗДгІЮЊ_________________ЃЛгыЁАCO2ЦчЛЏЗЈЁБЯрБШЃЌЁАЕчНтЗЈЁБЕФЯджјгХЕуЪЧ____________________ЁЃ
ЁОД№АИЁП діДѓЗДгІЮяЕФНгДЅУцЃЌМгПьЛЏбЇЗДгІЫйТЪЃЛЬсИпдСЯЕФРћгУТЪ 3MnO2 + 6KOH + KClO3 ![]() 3K2MnO4 + KCl + 3H2O d 2ЁУ1 ЗРжЙЮТЖШЙ§ИпЕМжТKMnO4ЗжНт ЫЎдЁМгШШ MnO2 MnO42-Ѓe- = MnO4- KMnO4ЕФДПЖШИпЁЂВњТЪИп
3K2MnO4 + KCl + 3H2O d 2ЁУ1 ЗРжЙЮТЖШЙ§ИпЕМжТKMnO4ЗжНт ЫЎдЁМгШШ MnO2 MnO42-Ѓe- = MnO4- KMnO4ЕФДПЖШИпЁЂВњТЪИп
ЁОНтЮіЁПЃЈ1ЃЉЙЄвЕЩњВњжаНЋдСЯЗлЫщЕФФПЕФвЛАуЪЧЮЊСЫдіДѓЗДгІЮяЕФНгДЅУцЛ§ЃЌМгПьЗДгІЫйТЪЃЌЭЌЪБОЁСПНЋИќЖрЕФдСЯзЊЛЏЮЊВњЮяЃЌвдЬсИпдСЯЕФРћгУТЪЁЃ
ЃЈ2ЃЉЁАКцГДЁБЪБНЋMnO2ЁЂKClO3КЭKOHзЊЛЏЮЊK2MnO4КЭKClЃЌЗНГЬЪНЮЊЃК3MnO2 + 6KOH + KClO3 ![]() 3K2MnO4 + KCl + 3H2OЁЃвђЮЊЙ§ГЬжаМгШыСЫЧтбѕЛЏМиетбљЕФЧПМюЃЌЫљвдФмгыЧПМюЗДгІЕФЮяжЪЖМВЛФмЪЙгУЃЌР§ШчЃЌЪЏгЂЃЈЖўбѕЛЏЙшЃЉЁЂбѕЛЏТСКЭЬеДЩЃЈЦфжаКЌгаЖўбѕЛЏЙшЃЉЃЌЫљвджЛФмЪЙгУЬњлсліЃЌбЁЯюdе§ШЗЁЃ
3K2MnO4 + KCl + 3H2OЁЃвђЮЊЙ§ГЬжаМгШыСЫЧтбѕЛЏМиетбљЕФЧПМюЃЌЫљвдФмгыЧПМюЗДгІЕФЮяжЪЖМВЛФмЪЙгУЃЌР§ШчЃЌЪЏгЂЃЈЖўбѕЛЏЙшЃЉЁЂбѕЛЏТСКЭЬеДЩЃЈЦфжаКЌгаЖўбѕЛЏЙшЃЉЃЌЫљвджЛФмЪЙгУЬњлсліЃЌбЁЯюdе§ШЗЁЃ
ЃЈ3ЃЉЯђШмвКжаЭЈШыЖўбѕЛЏЬМЪБЃЌгІИУЪЧK2MnO4ЗЂЩњЦчЛЏЃЌЦфжаЕФMnЕФЛЏКЯМлвЛВПЗжЩ§ИпвЛВПЗжНЕЕЭЃЌЕУЕНKMnO4КЭMnO2ЃЌЗНГЬЪНЮЊ3K2MnO4 + 4CO2 + 2H2O = 2KMnO4 + MnO2Ё§ + 4KHCO3ЃЌЫљвдбѕЛЏВњЮяЃЈKMnO4ЃЉгыЛЙдВњЮяЃЈMnO2ЃЉЕФЮяжЪЕФСПжЎБШЮЊ2:1ЁЃ
ЃЈ4ЃЉИпУЬЫсМидкНЯИпЮТЖШЛсЗЂЩњЗжНтЗДгІЃЌЫљвдеєЗЂХЈЫѕЕФЪБКђЃЌЮТЖШВЛвЫЙ§ИпЁЃеєЗЂЮТЖШЮЊ60ЁцЃЌЕЭгкЫЎЕФЗаЕуЃЌЫљвдБШНЯКЯЪЪЕФЗНЗЈЪЧЫЎдЁМгШШЁЃ
ЃЈ5ЃЉдкЙ§ТЫетвЛВНЕУЕНЕФMnO2ПЩвдМгШыЕНЕквЛВНЕФКцГДжаЃЌЫљвдMnO2ПЩвдбЛЗЁЃ
ЃЈ6ЃЉЕчНтЪБЃЌНЋK2MnO4зЊЛЏЮЊKMnO4ЃЌЦфжаMnЕФЛЏКЯМлЩ§ИпЃЌЫљвдбєМЋЩЯЪЇЕчзгЛЏКЯМлЩ§ИпЕФЗДгІОЭЪЧЃКMnO42-Ѓe- = MnO4-ЁЃгыЁАCO2ЦчЛЏЗЈЁБЯрБШЃЌЁАЕчНтЗЈЁБЕФЯджјгХЕуЪЧНЋЫљгаЕФУЬдЊЫиЖМзЊЛЏЮЊИпУЬЫсМиЃЌЬсИпСЫИпУЬЫсМиЕФВњТЪЃЌЭЌЪБЕУЕНЕФЩњГЩЮяЕФДПОЛЖШвВНЯИпЁЃ


 дФЖСПьГЕЯЕСаД№АИ
дФЖСПьГЕЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПОнБЈЕРЃЌдк300ЁцЁЂ70MPaЯТгЩЖўбѕЛЏЬМКЭЧтЦјКЯГЩввДМвбГЩЮЊЯжЪЕЁЃ2CO2(g)+6H2(g)![]() CH3CH2OH(g)+3H2O(g) ЯТСаа№ЪіДэЮѓЕФЪЧ
CH3CH2OH(g)+3H2O(g) ЯТСаа№ЪіДэЮѓЕФЪЧ
A. ЪЙгУCu-Zn-FeДпЛЏМСПЩДѓДѓЬсИпЩњВњаЇТЪ
B. ЗДгІашдк300ЁцНјааПЩЭЦВтИУЗДгІЪЧЮќШШЗДгІ
C. ГфШыДѓСПCO2ЦјЬхПЩЬсИпH2ЕФзЊЛЏТЪ
D. ДгЦНКтЛьКЯЦјЬхжаЗжРыГіCH3CH2OHКЭH2OПЩЬсИпCO2КЭH2ЕФРћгУТЪ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПСђЫсбЧЬњяЇгжГЦФЊЖћбЮЃЌЪЧЧГТЬЩЋОЇЬхЃЎЫќдкПеЦјжаБШвЛАубЧЬњбЮЮШЖЈЃЌЪЧГЃгУЕФFe2+ЪдМСЃЎФГЪЕбщаЁзщРћгУЙЄвЕЗЯЬњаМжЦШЁФЊЖћбЮЃЌВЂВтЖЈЦфДПЖШЃЎ
вбжЊЃКЂй
| 10 | 20 | 30 | 40 | 50 | 70 |
ЃЈNH4)2SO4 | 73.3 | 75.4 | 78.0 | 81.0 | 84.5 | 91.9 |
FeSO47H2O | 40.0 | 48.0 | 60.0 | 73.3 | Љ | Љ |
ЃЈNH4ЃЉ2SO4FeSO46H2O | 18.1 | 21.2 | 24.5 | 27.9 | 31.3 | 38.5 |
ЂкФЊЖћбЮдкввДМШмМСжаФбШмЃЎ
ЂёЃЎФЊЖћбЮЕФжЦШЁ

ЪдЗжЮіЃК
ЃЈ1ЃЉБиаыдкЬњаМЩйСПЪЃгрЪБНјааЙ§ТЫЃЌЦфдвђЪЧ______________________ЃЎ
ЃЈ2ЃЉВНжш3жаАќКЌЕФЪЕбщВйзїУћГЦ_____________________ЃЎ
ЃЈ3ЃЉВњЦЗФЊЖћбЮзюКѓгУ______________________ ЯДЕгЃЈЬюзжФИБрКХЃЉЃЎ
aЃЎеєСѓЫЎ bЃЎввДМ cЃЎТЫвК
ЂђЃЎЮЊВтЖЈСђЫсбЧЬњяЇЃЈNH4ЃЉ2SO4FeSO46H2OОЇЬхДПЖШЃЌФГбЇЩњШЁm gСђЫсбЧЬњяЇбљЦЗХфжЦГЩ500mLШмвКЁЃИљОнЮяжЪзщГЩМзЁЂввЁЂБћШ§ЮЛЭЌбЇЩшМЦСЫШчЯТШ§ИіЪЕбщЗНАИЃЌЧыЛиД№ЃК
ЗНАИвЛЃКШЁ20.00mLСђЫсбЧЬњяЇШмвКгУ0.1000molLЉ1ЕФЫсадKMnO4ШмвКЗжШ§ДЮНјааЕЮЖЈЃЎ
ЗНАИЖўЃКШЁ20.00mLСђЫсбЧЬњяЇШмвКНјааШчЯТЪЕбщЃЎ
![]()
ЃЈ4ЃЉШєЪЕбщВйзїЖМе§ШЗЃЌЕЋЗНАИвЛЕФВтЖЈНсЙћзмЪЧаЁгкЗНАИЖўЃЌЦфПЩФмдвђЮЊ_________ЃЌбщжЄЭЦВтЕФЗНЗЈЮЊЃК___________________________________________ЗНАИШ§ЃКЃЈЭЈЙ§NH4+ВтЖЈЃЉЪЕбщЩшМЦЭМШчЯТЫљЪОЃЎШЁ20.00mLСђЫсбЧЬњяЇШмвКНјааИУЪЕбщЃЎ

ЃЈ5ЃЉзАжУ___________ ЃЈЬюЁАМзЁБЛђЁАввЁБЃЉНЯЮЊКЯРэЃЌХаЖЯРэгЩЪЧ_______________ЃЎ
ЃЈ6ЃЉСПЦјЙмжазюМбЪдМСЪЧ__________ ЃЈЬюзжФИБрКХЃЎШчбЁЁАввЁБдђЬюДЫПеЃЌШчбЁЁАМзЁБДЫПеПЩВЛЬюЃЉЃЎ
aЃЎЫЎ bЃЎБЅКЭNaHCO3ШмвК cЃЎCCl4
ЃЈ7ЃЉШєВтЕУNH3ЕФЬхЛ§ЮЊV LЃЈвбелЫуЮЊБъзМзДПіЯТЃЉЃЌдђИУСђЫсбЧЬњяЇОЇЬхЕФДПЖШЮЊ_______ЃЎ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПГЦШЁСНЗнТСЗлЃЌЕквЛЗнМгзуСПЕФNaOHШмвКЃЌЕкЖўЗнМгзуСПЕФбЮЫсЃЌШєЗХГіЕШСПЕФЦјЬхЃЌдђСНЗнТСЗлЕФжЪСПБШЮЊЃЈ ЃЉ
A.1ЃК1B.2ЃК3C.1ЃК2D.1ЃК3
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПМКжЊЗДгІA+3B=2C+DЃЌдкФГЖЮЪБМфФквдAЕФХЈЖШБфЛЏБэЪОЕФЛЏбЇЗДгІЫйТЪЮЊ1 mol/(L.min)ЃЌдђДЫЖЮЪБМфФквдCЕФХЈЖШБфЛЏБэЪОЕФЛЏбЇЗДгІЫйТЪЮЊ( )
A.0.5 mol/(LЁЄmin)B.1 mol/(LЁЄmin)C.2 mol/(LЁЄmin)D.3 mol/(LЁЄmin)
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПдк25ЁцЁЂ101 kPaЯТЃЌ1 gМзДМШМЩеЩњГЩCO2КЭвКЬЌЫЎЪБЗХШШ22.68 kJ,ЯТСаШШЛЏбЇЗНГЬЪНе§ШЗЕФЪЧЃЈ ЃЉ
A. CH3OHЃЈlЃЉ+![]() O2ЃЈgЃЉ===CO2ЃЈgЃЉ+2H2OЃЈlЃЉЃЛІЄH=" +725.8" kJ/mol
O2ЃЈgЃЉ===CO2ЃЈgЃЉ+2H2OЃЈlЃЉЃЛІЄH=" +725.8" kJ/mol
B. 2CH3OHЃЈlЃЉ+3O2ЃЈgЃЉ===2CO2ЃЈgЃЉ+4H2OЃЈlЃЉЃЛІЄH= Ѓ1452 kJ/mol
C. 2CH3OHЃЈlЃЉ+3O2ЃЈgЃЉ===2CO2ЃЈgЃЉ+4H2OЃЈlЃЉЃЛІЄH= Ѓ725.8 kJ/mol
D. 2CH3OHЃЈlЃЉ+3O2ЃЈgЃЉ===2CO2ЃЈgЃЉ+4H2OЃЈlЃЉЃЛІЄH=" +1452" kJ/mol
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФГЮТЖШЪБЃЌдквЛИі2LЕФУмБеШнЦїжаЃЌXЁЂYЁЂZШ§жжЦјЬЌЮяжЪЕФЮяжЪЕФСПЫцЪБМфЕФБфЛЏЧњЯпШчЭМЫљЪОЁЃИљОнЭМжаЪ§ОнЃЌЪдЬюаДЯТСаПеАзЃК

ЃЈ1ЃЉИУЗДгІЕФЛЏбЇЗНГЬЪНЮЊ_______________________ЃЛ
ЃЈ2ЃЉДгПЊЪМжС2minЃЌZЕФЦНОљЗДгІЫйТЪЮЊ___________ЃЛ
ЃЈ3ЃЉЗДгІДяЦНКтЪБЃЌЬхЯЕЕФбЙЧПЪЧПЊЪМЪБЕФ____________БЖЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСавЧЦїЪЙгУЧАБиаыМьВщЪЧЗёТЉЫЎЕФга ЃЈЬюађКХЃЉ
A.ШнСПЦП
B.еєСѓЩеЦП
C.ЗжвКТЉЖЗ
D.СПЭВ
E.еєЗЂУѓЃЎ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЁАБљЃЌЫЎЮЊжЎЃЌЖјКЎгкЫЎЁБЙигкЫЎФ§НсГЩБљЕФЙ§ГЬЕФУшЪіе§ШЗЕФЪЧЃЈ ЃЉ
A. ЁїH > 0 ЃЌЁїS > 0 B. ЁїH > 0 ЃЌЁїS < 0
C. ЁїH < 0 ЃЌЁїS > 0 D. ЁїH < 0 ЃЌЁїS < 0
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com