
【题目】“冰,水为之,而寒于水”关于水凝结成冰的过程的描述正确的是( )
A. △H > 0 ,△S > 0 B. △H > 0 ,△S < 0
C. △H < 0 ,△S > 0 D. △H < 0 ,△S < 0
科目:高中化学 来源: 题型:
【题目】工业上以软锰矿(主要成分为MnO2) 为主要原料制备高锰酸钾(KMnO4)的工艺流程如下:
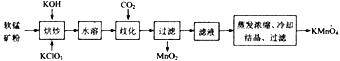
回答下列问题:
(1)原料软锰矿在使用之前通常需粉碎,其目的是_________________________________。
(2)“烘炒”时是将混合物放入某种材质的坩埚内,混合均匀,小火加热至熔融,有K2MnO4和KCl生成,则烘炒过程中发生反应的化学方程式为________________;“烘炒”时所用坩埚的材质可以选用_______(填字母)。
a.石英 b.氧化铝 c.硅酸盐陶瓷 d.铁
(3)已知水溶过程中无化学反应发生,通入CO2使反应体系呈中性或弱酸性即可发生歧化反应,则歧化时发生反应的氧化产物与还原产物的物质的量之比为_______________。
(4)对滤液进行蒸发浓缩时,温度不宜超过60℃,其原因是_________________;将蒸发温度控制在60℃左右的最佳操作方法是_______________________。
(5)流程中可以循环利用的物质是___________________。
(6)用CO2歧化法将K2MnO4转化为KMnO4属于传统工艺,现代工艺多采用电解法,即电解K2MnO4水溶液,电解槽中阳极发生的电极反应为_________________;与“CO2歧化法”相比,“电解法”的显著优点是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I(化学反应原理)
(1)25℃,100 mL氢氧化钡溶液中含有1×10-3 mol的OH-,该溶液的pH为_________。
(2)常温下,CuCl2的水溶液呈_____(填“酸”、“中”或“碱”)性,原因是_______________(用离子方程式表示)。
(3)把AlCl3溶液在空气中蒸干、灼烧,最后得到的主要固体产物是_________。
(4)等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液中
c(Na+)________c(CH3COO-)(填“ >”、“=”或“<” )。
II(化学与生活)
有四种常见药物 ①阿司匹林 ②青霉素 ③胃舒平 ④麻黄碱.请回答:
(1)某同学胃酸过多,应选用的药物是______(填序号),抗酸药是治疗胃酸过多的一类药品,请写出一种抗酸药(有效成分是碳酸钙)中和胃酸过多的化学反应方程式:___________________________。
(2)由于具有兴奋作用,国际奥委会严禁运动员服用的药物是_________(填序号)。
(3)从用药安全角度考虑,使用前要进行皮肤敏感性测试的药物是_______(填序号)。
(4)滥用药物会导致不良后果,如过量服用________(填序号)会出现水杨酸中毒,应立即停药,并静脉注射___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列五种短周期元素的电离能数据(单位:kJ·mol-1),回答下列问题。

(1)在这五种元素中,最可能处于同一族的两种元素是______________(填元素符号),S元素最可能是________区元素。
(2)基态Q元素原子的价电子排布式是___________。Q和T同周期,化合物QT中T元素的化合价为____________;第一电离能介于Q、T之间的同周期元素有____________种。
(3)化合物RT3中含有的化学键类型为____________,RT3中阴离子的几何构型为__________。
(4)下列元素中,化学性质和物理性质与U元素相似的是________(填序号)。
A.硼 B.铍 C.锂 D.氦 E.碳
(5)R的某种氧化物X的晶胞结构如图所示,晶胞参数a=0.566nm,X的化学式为________:晶体X的密度是____________(g·cm-3)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室欲配制80 g质量分数为10%的氢氧化钠溶液,如图是配制该氢氧化钠溶液的实验操作示意图。
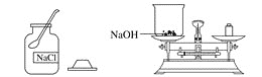
实验步骤
(1)计算:需要氢氧化钠固体__________g,水__________mL(水的密度为1 g·mL-1)。
(2)称量:用托盘天平称取氢氧化钠固体,用规格为__________(填“10mL”“50mL”或“100mL”)的量筒量取所需要的水,倒入盛有氢氧化钠的烧杯中。
(3)溶解:用玻璃棒搅拌,使氢氧化钠固体完全溶解。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各选项有机物数目,与分子式为ClC4H7O2且能与碳酸氢钠反应生成气体的有机物数目相同的是(不含立体异构)( )
A. 分子式为C5H10的烯烃
B. 分子式为C4H8O2的酯
C. 甲苯( )的一氯代物
)的一氯代物
D. 立体烷(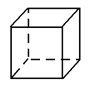 )的二氯代物
)的二氯代物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种优良的消毒剂,常将其制成NaClO2固体,以便运输和贮存,过氧化氢法备NaClO2固体的实验装置如图所示。
已知:①2NaC1O3+H2O2+H2SO4=2C1O2↑+O2↑+Na2SO4+2H2O
2ClO2+H2O2+2NaOH=2NaClO2+O2↑+2H2O
②ClO2熔点-59℃、沸点11℃,浓度过高时易发生分解;
③H2O2沸点150℃
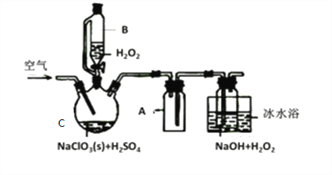
(1)仪器C的名称是__________________,仪器A的作用是_________________,冰水浴冷却的目的是_____________________和___________________________。
(2)该装置不完善的方面是________________________。
(3)空气流速过快或过慢,均降低NaClO2产率,试解释其原因,空气流速过慢时,___________;空气流速过快时,________________。
(4)Cl-存在时会催化ClO2的生成。反应开始时在C中加入少量盐酸,ClO2的生成速率大大提高,并产生微量氯气。该过程可能经两步完成,请将其补充完整:
①_____________________________(用离子方程式表示)
②H2O2+Cl2=2Cl-+O2+2H+
(5)NaClO2纯度测定:
①准确称取所得NaClO2样品10.0g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(C1O2-的产物为Cl-),将所得混合液配成250mL待测溶液;
②取25.00mL待测液,用2.0mol·L-1Na2S2O3标准液滴定(I2+2S2O32-=2I-+S4O62-),以淀粉溶液做指示剂,达到滴定终点时的现象为__________________________,重复滴定3次,测得Na2S2O3标准液平均用量为20.00mL,则该样品中NaClO2的质量分数为_________________。(M(NaClO2)=90.5g/mol)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com