
【题目】实验室欲配制80 g质量分数为10%的氢氧化钠溶液,如图是配制该氢氧化钠溶液的实验操作示意图。
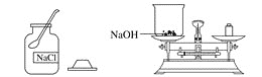
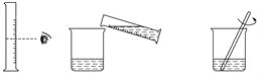
实验步骤
(1)计算:需要氢氧化钠固体__________g,水__________mL(水的密度为1 g·mL-1)。
(2)称量:用托盘天平称取氢氧化钠固体,用规格为__________(填“10mL”“50mL”或“100mL”)的量筒量取所需要的水,倒入盛有氢氧化钠的烧杯中。
(3)溶解:用玻璃棒搅拌,使氢氧化钠固体完全溶解。
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
【题目】己知反应A+3B=2C+D,在某段时间内以A的浓度变化表示的化学反应速率为1 mol/(L.min),则此段时间内以C的浓度变化表示的化学反应速率为( )
A.0.5 mol/(L·min)B.1 mol/(L·min)C.2 mol/(L·min)D.3 mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I(化学反应原理)
恒温恒容下,将2mol气体A和2mol气体B通入体积为2L的密闭容器中,发生如下反应:2A(g)+B(g)![]() xC(g)+2D(s),2min后反应达到平衡状态,此时剩余1.2mol B,并测得C的浓度为1.2mol/L。
xC(g)+2D(s),2min后反应达到平衡状态,此时剩余1.2mol B,并测得C的浓度为1.2mol/L。
(1)从开始反应到平衡状态,生成C的平均反应速率为__________。
(2)x=_________,该反应的化学平衡表达式为________________。
(3)A的转化率与B的转化率之比为________。
(4)下列各项可作为该反应达到平衡状态的标志是_______ (填字母)。
A.压强不再变化 B.气体密度不再变化
C.气体平均相对分子质量不再变化 D. A的消耗速率与B的消耗速率之比为2:1
II (化学与生活)
保持营养平衡、科学使用食品添加剂并合理使用药物,有助于健康和提高人体自身免疫力.
①如图为某品牌鸡精标签的一部分,其中能水解生成氨基酸的配料是________,属于着色剂的是_____,属于防腐剂的是____________。

②在一支盛有2mL2%淀粉溶液的试管中滴入2滴碘水.溶液呈蓝色,再滴入维生素C的水溶液,溶液颜色变化是__________,该实验说明维生素C具有___________性(选填:“酸”、“氧化”或“还原”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究物质制备是化学学科的任务之一。
(1)请从Cl2、H2、CO2、NO、NH3五种气体中选择一种气体,该气体在实验室可用如图装置制取、净化、收集(可以含水蒸气),制取该气体的化学方程式为____________。

(2)已知: +4NaOH→NaCl+CH2=CH2↑+Na3PO4+3H2O,可用下述装置制取1,2-二溴乙烷(无色液体,密度2.18g·cm-3,熔、沸点分别为9.79℃、131.4 ℃,不溶于水);试管d中装有液溴(表面覆盖少量水)。
+4NaOH→NaCl+CH2=CH2↑+Na3PO4+3H2O,可用下述装置制取1,2-二溴乙烷(无色液体,密度2.18g·cm-3,熔、沸点分别为9.79℃、131.4 ℃,不溶于水);试管d中装有液溴(表面覆盖少量水)。

①e装置的作用是_________;当观察到_________现象时,试管d中反应基本结束;
②若用冰水代替烧杯中的冷水,可能引起的不安全后果是_________;
③实验后,需通过水洗、________、水洗、用干燥剂干燥、蒸馏等操作对试管d中的粗产品进行精制:
④实验消耗40%乙烯利(摩尔质量为M)溶液50g,制得产品m g,则乙烯利合成1,2-二溴乙烷的产率为____________(用含M、m的代数式表示);
⑤设计实验证明,反应后烧瓶中的混合溶液含有C1-、PO43-。简述实验方案:_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“冰,水为之,而寒于水”关于水凝结成冰的过程的描述正确的是( )
A. △H > 0 ,△S > 0 B. △H > 0 ,△S < 0
C. △H < 0 ,△S > 0 D. △H < 0 ,△S < 0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、R、T的原子半径与原子序数关系如下图所示。R原子最外层电子数是电子层数的2倍,Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成的化合物Z2T能破坏水的电离平衡。下列推断正确的是

A. 原子半径和离子半径均满足:Y<Z
B. 氢化物的沸点不一定是:Y>R
C. 最高价氧化物对应水化物的酸性:T<R
D. 由X、R、Y、Z四种元素组成的化合物水溶液一定显碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】单质碘在水中的溶解度较小,且溶解较慢。实验室配制碘水时,往往将碘单质加入稀KI溶液中。该溶液中存在平衡: ![]() 。该反应的平衡常数K随温度变化规律如图所示。下列说法中,正确的是
。该反应的平衡常数K随温度变化规律如图所示。下列说法中,正确的是

A. 向上述体系中加入CCl4,平衡不移动
B. 25 C时,向上述体系中加入少量I2,平衡向右移动,平衡常数大于680
C. 该反应的平衡常数表达式为
D. 该反应的正反应为放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种可连续使用的锂电池结构如图所示,下列有关该电池放电时的说法正确的是

A. 电子由Li电极经Li+透过膜进入Fe2+、Fe3+的水溶液移向Ti电极
B. Ti电极上发生的电极反应为:Fe3+ + e- = Fe2+
C. Li+透过膜除允许Li+通过外,还允许H2O分子通过
D. 贮罐中发生的离子反应为:S2O82- + 2Fe3+ = 2Fe2+ + 2SO42-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com