
【题目】根据下列五种短周期元素的电离能数据(单位:kJ·mol-1),回答下列问题。

(1)在这五种元素中,最可能处于同一族的两种元素是______________(填元素符号),S元素最可能是________区元素。
(2)基态Q元素原子的价电子排布式是___________。Q和T同周期,化合物QT中T元素的化合价为____________;第一电离能介于Q、T之间的同周期元素有____________种。
(3)化合物RT3中含有的化学键类型为____________,RT3中阴离子的几何构型为__________。
(4)下列元素中,化学性质和物理性质与U元素相似的是________(填序号)。
A.硼 B.铍 C.锂 D.氦 E.碳
(5)R的某种氧化物X的晶胞结构如图所示,晶胞参数a=0.566nm,X的化学式为________:晶体X的密度是____________(g·cm-3)。

【答案】 B和Al p 2s22p1 -3 3 离子键、共价键 直线型 D Na2O 2.27g/cm3
【解析】这五种元素的短周期元素,Q第三电离能和第四电离能相差较大,所以Q为第IIIA族元素;R元素第一电离能远远小于第二电离能,所以R元素为第IA族元素;S元素第四电离能远远大于第三电离能,则S为第IIIA族元素;T和U元素电离能没有太明显的突变,说明T和U元素最外层电子数都在5个以上,根据同周期第一电离能依次增大的原则,U的原子序数应该大于T。
(1)通过以上分析,可知最可能处于同一族的两种元素是Q和S位于第IIIA族,所以应该是B和Al元素,根据第一电离能大小判断,Q为B,S为Al,Al位于p区,故答案为: B和Al; p。
(2)Q是B元素,B的价电子排布式为2s22p1;Q和T同周期,形成化合物QT,所以T为N元素,N的化合价为-3价;因为Be的2s是全充满,N的2p半充满,所以第一电离能介于B、N之间的同周期元素有:Be、C、O,故答案为:2s22p1 ;-3 ;3。
(3)R为Na,T为N,化合物RT3为NaN3中含有的化学键类型应该是离子键和共价键;RT3中阴离子为N3-离子,N3-价电子总数为16个,与CO2为等电子体,所以空间构型为直线型,故答案为:离子键、共价键;直线型。
(4)U元素的各级电离能都比较大,最有可能是惰性气体元素,所以化学性质和物理性质与U元素相似的是氦,故选D。
(5)R为Na元素,晶胞中大球和小球的数量之比为1:2,所以该氧化物为Na2O,一个晶胞中包含了4个Na2O,晶胞参数a=0.566nm=0.566×10-8cm,由此计算晶胞的密度为: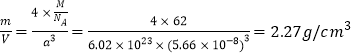


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】称取两份铝粉,第一份加足量的NaOH溶液,第二份加足量的盐酸,若放出等量的气体,则两份铝粉的质量比为( )
A.1:1B.2:3C.1:2D.1:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于下图所示实验,下列实验现象预测或操作正确的是

A. 实验甲:匀速逐滴滴加盐酸时,试管中没气泡产生和有气泡产生的时间段相同
B. 实验乙:充分振荡后静置,下层溶液为橙红色,上层为无色
C. 实验丙:由MgCl26H2O制备无水MgCl2
D. 装置丁:酸性KMnO4溶液中有气泡出现,且溶液颜色会逐渐变浅乃至褪去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I(化学反应原理)
恒温恒容下,将2mol气体A和2mol气体B通入体积为2L的密闭容器中,发生如下反应:2A(g)+B(g)![]() xC(g)+2D(s),2min后反应达到平衡状态,此时剩余1.2mol B,并测得C的浓度为1.2mol/L。
xC(g)+2D(s),2min后反应达到平衡状态,此时剩余1.2mol B,并测得C的浓度为1.2mol/L。
(1)从开始反应到平衡状态,生成C的平均反应速率为__________。
(2)x=_________,该反应的化学平衡表达式为________________。
(3)A的转化率与B的转化率之比为________。
(4)下列各项可作为该反应达到平衡状态的标志是_______ (填字母)。
A.压强不再变化 B.气体密度不再变化
C.气体平均相对分子质量不再变化 D. A的消耗速率与B的消耗速率之比为2:1
II (化学与生活)
保持营养平衡、科学使用食品添加剂并合理使用药物,有助于健康和提高人体自身免疫力.
①如图为某品牌鸡精标签的一部分,其中能水解生成氨基酸的配料是________,属于着色剂的是_____,属于防腐剂的是____________。

②在一支盛有2mL2%淀粉溶液的试管中滴入2滴碘水.溶液呈蓝色,再滴入维生素C的水溶液,溶液颜色变化是__________,该实验说明维生素C具有___________性(选填:“酸”、“氧化”或“还原”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“冰,水为之,而寒于水”关于水凝结成冰的过程的描述正确的是( )
A. △H > 0 ,△S > 0 B. △H > 0 ,△S < 0
C. △H < 0 ,△S > 0 D. △H < 0 ,△S < 0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各图示与对应的描述相符合的是

A. 图甲表示分别稀释pH=11的NaOH溶液和氨水时溶液pH的变化,图中b>a=100
B. 图乙表示某化学平衡的移动,在t1时改变的条件一定是加入催化剂
C. 图丙表示平衡2NO2(g)![]() N2O4(g)在t1时迅速将体积缩小后c(N2O4)的变化
N2O4(g)在t1时迅速将体积缩小后c(N2O4)的变化
D. 图丁表示CH3COOH溶液中通入NH3至过量的过程中溶液导电性的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2020年6月5日世界环境日主题为“关爱自然,刻不容缓”,人们应具备绿色化学的理念,下列说法错误的是( )
A.尽可能使用无毒无害的原材料
B.尽可能减少生产过程中的能量消耗
C.治理产生的污染优于防治污染的产生
D.尽可能采用对人类和环境低毒或无毒的合成路线
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com