
【题目】下列反应中必须加入还原剂才能进行的是( )
A.MnO4﹣→Mn2+
B.H2O2→H2O
C.H2→H2O
D.Zn→Zn2+
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 石油裂解气可以使溴水褪色,也可以使高锰酸钾溶液褪色,但褪色原理不同
B. 在酒化酶的作用下葡萄糖厌氧发酵可以生成乙醇
C. 石油裂化的目的是为了提高轻质油的质量和产量
D. CH2=CHCH3+Cl2![]() CH2=CHCH2 Cl+ HCl属于取代反应
CH2=CHCH2 Cl+ HCl属于取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1.52g 铜镁合金完全溶解于50mL 密度为1.40 g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120 mL(标准状况),向反应后的溶液中加入1.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法不正确的是( )。
A. 该合金中铜与镁的物质的量之比是2:1
B. 该浓硝酸中HNO3的物质的量浓度是14.0 mol/L
C. NO2和N2O4的混合气体中,NO2的体积分数是80%
D. 得到2.54 g沉淀时,加入NaOH溶液的体积是600 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃、101 kPa下,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ,下列热化学方程式正确的是( )
A. CH3OH(l)+![]() O2(g)===CO2(g)+2H2O(l);ΔH=" +725.8" kJ/mol
O2(g)===CO2(g)+2H2O(l);ΔH=" +725.8" kJ/mol
B. 2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l);ΔH= -1452 kJ/mol
C. 2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l);ΔH= -725.8 kJ/mol
D. 2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l);ΔH=" +1452" kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)常温下,0.05 mol/L的硫酸溶液的pH=___,水电离出的c(H+)=___mol/L。
(2)在常温下,水电离出的c(H+)=1×10-13 mol·L-1的NaOH溶液中,pH=__________,c(NaOH)=_______mol·L-1。
(3)某温度下,纯水的c(H+)=2×10-7 mol·L-1,则此时纯水的c(OH-)为________。若温度不变,滴入稀盐酸使c(H+)=5×10-4 mol·L-1,则溶液中c(OH-)为________,此时温度________(填“高于”、“低于”或“等于”)25℃。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D都是中学化学中的常见物质,其中A、B、C均含有同一种元素,A是一种强碱,C为厨房中的用品,在—定条件下相互转化关系如图(部分反应中的水己略去)。下列有关B、C的说法正确的是

A. 可以用BaCl2或CaCl2稀溶液或Ba(OH)2稀溶液鉴别B、C两种溶液
B. 分别取等质量的B、C两种固体与等体积等浓度盐酸反应,产生气体的速率一样
C. 取agB、C的混合物充分加热,固体质量减重bg,由此可计算出混合物中B的质量分数
D. 取a gB、C的混合物与足量稀硫酸充分反应,逸出的气体碱石灰完全吸收,增重bg,由此可计算出混合物中B的质量分数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F为原子序数依次增大的六种元素,位于元素周期表的前四周期。B元素原子含有3个能级,且每个能级所含的电子数相同;D的原子核外有8种运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子3d轨道上有4个未成对电子。请回答下列问题:
(1)写出D基态原子的价电子排布图__________,F基态原子的外围电子排布式________。
(2)下列说法不正确的是____________(填序号)。
A.二氧化硅的相对分子质量比二氧化碳大,所以沸点:SiO2>CO2
B.第一电离能由小到大的顺序:B
C.N2与CO为等电子体,结构相似
D.稳定性:H2O>H2S,水分子更稳定的原因是水分子间存在氢键
(3)F元素位于周期表中_____区,其离子是人体内多种酶的辅因子,人工模拟酶是当前研究的热点。向F的硫酸盐溶液中通入过量的C与A形成的气体X可生成[F(X)4]2+,该离子的结构式为_____________(用元素符号表示)。
(4)某化合物与F(I)(I表示化合价为+1)结合形成图1所示的离子,该离子中碳原子的杂化方式为_________。
(5)B单质的一种同素异形体的晶胞如图2所示,则一个晶胞中所含B原子的个数为______。
(6)试从分子的立体构型和原子的电负性、中心原子上的孤电子对等角度解释与D的简单氢化物结构十分相似的OF2的极性很小的原因是____________。
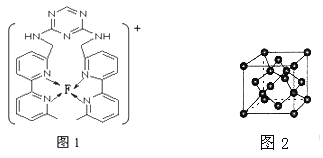
(7)D与F形成离子个数比为1:1的化合物,晶胞与NaCl类似,设D离子的半径为apm。F离子的半径bpm,则该晶胞的空间利用率为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1×105Pa、298K时,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是( )
A.H2O(g) = H2(g) + 1/2O2(g) △H= +242kJ·mol-1
B.2H2(g) + O2(g) = 2H2O(l) △H= +484kJ·mol-1
C.H2(g) + 1/2O2(g) = H2O(g) △H= +242kJ·mol-1
D.2H2(g) + O2(g) = 2H2O(g) △H= +484kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com