
【题目】A、B、C、D、E、F为原子序数依次增大的六种元素,位于元素周期表的前四周期。B元素原子含有3个能级,且每个能级所含的电子数相同;D的原子核外有8种运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子3d轨道上有4个未成对电子。请回答下列问题:
(1)写出D基态原子的价电子排布图__________,F基态原子的外围电子排布式________。
(2)下列说法不正确的是____________(填序号)。
A.二氧化硅的相对分子质量比二氧化碳大,所以沸点:SiO2>CO2
B.第一电离能由小到大的顺序:B
C.N2与CO为等电子体,结构相似
D.稳定性:H2O>H2S,水分子更稳定的原因是水分子间存在氢键
(3)F元素位于周期表中_____区,其离子是人体内多种酶的辅因子,人工模拟酶是当前研究的热点。向F的硫酸盐溶液中通入过量的C与A形成的气体X可生成[F(X)4]2+,该离子的结构式为_____________(用元素符号表示)。
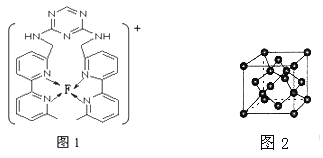
(4)某化合物与F(I)(I表示化合价为+1)结合形成图1所示的离子,该离子中碳原子的杂化方式为_________。
(5)B单质的一种同素异形体的晶胞如图2所示,则一个晶胞中所含B原子的个数为______。
(6)试从分子的立体构型和原子的电负性、中心原子上的孤电子对等角度解释与D的简单氢化物结构十分相似的OF2的极性很小的原因是____________。
(7)D与F形成离子个数比为1:1的化合物,晶胞与NaCl类似,设D离子的半径为apm。F离子的半径bpm,则该晶胞的空间利用率为______________。
【答案】 ![]() 3dl04s1 ABD ds
3dl04s1 ABD ds 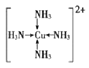 sp2、sp3 8 OF2和H2O的立体结构和似,同为V形,但是从电负性上看,氧与氢的电负性差大于氧与氟的电负性差,OF2中氧原子上有两对孤电子对,抵消了F-O键中共用电子对偏向F而产生的极性
sp2、sp3 8 OF2和H2O的立体结构和似,同为V形,但是从电负性上看,氧与氢的电负性差大于氧与氟的电负性差,OF2中氧原子上有两对孤电子对,抵消了F-O键中共用电子对偏向F而产生的极性 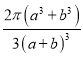
【解析】试题分析:A、B、C、D、E、F为原子序数依次增大的六种元素,位于元素周期表的前四周期。B元素原子含有3个能级,且每个能级所含的电子数相同,则B为碳元素;D的原子核外有8种运动状态不同的电子,则D为氧元素、C为氮元素;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子3d轨道上有4个未成对电子,则E为26号铁元素、F为29号铜元素。
(1)D基态原子的价电子排布图![]() ,F基态原子的外围电子排布式为3dl04s1。
,F基态原子的外围电子排布式为3dl04s1。
(2)A.二氧化硅可形成原子晶体,而二氧化碳可形成分子晶体,所以沸点:SiO2>CO2,A不正确;B.因为N原子的2p轨道处于半充满状态,所以第一电离能由小到大的顺序为C<O<N,B不正确;C.N2与CO为等电子体,结构相似,分子中都形成叁键,C正确;
D.O的非金属性强于S,所以稳定性H2O>H2S,水分子的稳定性与水分子间存在氢键无关,D不正确。综上所述,说法不正确的是ABD。
(3)因为F基态原子的外围电子排布式为3dl04s1,所以F元素位于周期表中ds区。向F的硫酸盐溶液中通入过量的氨气,可生成[Cu(NH3)4]2+,该离子的结构式为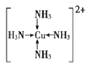 。
。
(4)由图可知,该离子中碳原子有两种,一种碳原子类似苯环上的碳原子,另一种是与其它原子全部形成单键,故碳原子的杂化方式为sp2、sp3。
(5)由B单质的一种同素异形体的晶胞结构示意图可知,该晶胞为金刚石的晶胞,一个晶胞中所含碳原子的个数为8(![]() )。
)。
(6)与H2O结构十分相似的OF2的极性很小的原因是:OF2和H2O的立体结构相似,同为V形,但是从电负性上看,氧与氢的电负性差大于氧与氟的电负性差,OF2中氧原子上有两对孤电子对,抵消了F-O键中共用电子对偏向F而产生的极性。
(7)D与F形成离子个数比为1:1的化合物CuO,晶胞与NaCl类似,设D离子的半径为apm。F离子的半径bpm,则该晶胞的边长为(2a+2b)pm,晶胞的体积为(2a+2b)3pm3;该晶胞中有4个Cu2+和4个O2-,4个Cu2+和4个O2-的总体积为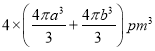 ,所以,此晶胞的空间利用率为
,所以,此晶胞的空间利用率为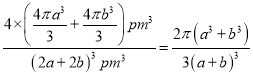 。
。


 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:
【题目】某银白色金属单质A在空气中加热燃烧时发出黄色火焰,得到淡黄色固体B,A暴露在空气中足够长时间变为C,B和酸性气体D能生成C,A和B都能与水生成E,E和D也能生成C。回答下列问题。
(1)写出下列物质的化学式:C_____________,D_____________,E_____________。
(2)写出下列反应的化学方程式:
①A和水生成E:______________________________________________________;
②B和D生成C:______________________________________________________;
③A在空气中加热:___________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I(化学反应原理)
甲、乙两池电极材料都是铁棒与碳棒如图。若两池中均盛放氯化钠溶液,反应一段时间后,请回答下列问题:

(1)甲池中铁作______极,乙池中铁作_______极。
(2)甲池中铁电极反应__________________,碳电极反应________________。
(3)乙池中总反应化学方程式__________________。
II(化学与生活)
材料与生活、生产息息相关,目前使用的材料主要有:金属材料、传统无机非金属材料、新型无机非金属材料、高分子材料、复合材料等。
(1)硅酸盐材料是重要的传统无机非金尾材料,也是日常生活、交通工具、建筑行业等不可缺少的材料之一。下列不属于硅酸盐产品的是___________(填写序号)
①光导纤维 ②水泥 ③玻璃 ④陶瓷
(2)玻璃是重要的建筑和装饰材料,玻璃属于______(填“纯净物”或“混合物”)。有些玻璃的花纹是利用氢氟酸对普通玻璃中的二氧化硅的腐蚀作用而制成的,写出该反应的化学方程式______。
(3)氮化硅是一种高温陶瓷材料,它的硬度大、熔点高,化学性质稳定。工业上普遍采用高纯硅与纯氮在1300℃反应获得氮化硅,该反应属于化学反应基本类型中的_____反应;已知氮化硅中硅元素的化合价为+4价,则氮化硅的化学式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝石墨双离子电池是一种全新低成本、高效电池。原理为:A1Li+Cx(PF6)![]() Al+xC+Li++PF6-。电池结构如图所示。下列说法正确的是
Al+xC+Li++PF6-。电池结构如图所示。下列说法正确的是

A. 放电时,外电路中电子向铝锂电极移动
B. 放电时,正极反应为Cx(PF6)+e-=xC+PF6-
C. 充电时,应将铝石墨电极与电源负极相连
D. 充电时,若电路中通过1 mol电子,阴极质量增加9 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】木炭在氧气中燃烧C(s)+O2(g)=CO2(g)反应中,反应前氧气的浓度2mol/L,30秒后,氧气的浓度降低到0.6mol/L,则计算:
(1)O2的反应速率多少___?
(2)计算生成CO2的浓度为多少___?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过膜电池可除去废水中的乙酸钠和对氯笨酚(![]() ),其原理如下图所示,下列说法正确的是
),其原理如下图所示,下列说法正确的是

A. B为电池的正极,发生还原反应
B. 电流方向从B极沿导线经小灯泡流向A极
C. A极的电极反应式为:![]()
D. 当外电路中有0.2mole-转移时,A极区增加的H+的数目为0.1NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com