
【题目】某银白色金属单质A在空气中加热燃烧时发出黄色火焰,得到淡黄色固体B,A暴露在空气中足够长时间变为C,B和酸性气体D能生成C,A和B都能与水生成E,E和D也能生成C。回答下列问题。
(1)写出下列物质的化学式:C_____________,D_____________,E_____________。
(2)写出下列反应的化学方程式:
①A和水生成E:______________________________________________________;
②B和D生成C:______________________________________________________;
③A在空气中加热:___________________________________________________。
【答案】Na2CO3 CO2 NaOH 2Na+2H2O═2NaOH+H2↑ 2Na2O2+2CO2═2Na2CO3+O2 2Na+O2![]() Na2O2
Na2O2
【解析】
某银白色金属单质A在空气中加热燃烧时发出黄色火焰,得到淡黄色固体B,则A是Na、B是Na2O2,A露置在空气中足够长时间变为C,银白色(钠的真面目)→变暗(生成Na2O)→变白色固体(生成NaOH)→成液(NaOH潮解)→结块(吸收CO2成Na2CO310H2O)→最后变成Na2CO3粉(风化),有关反应有:4Na+O2=2Na2O、Na2O+H2O=2NaOH、2NaOH+CO2=Na2CO3+H2O、Na2CO3+10H2O=Na2CO310H2O、Na2CO310H2O=Na2CO3+10H2O,则C是Na2CO3,B和酸性气体D能生成C,则D是CO2,A和B都能与水生成E,则E是NaOH;据此分析可得结论。
(1)通过以上分析知,A、B、C、D、E分别是Na、Na2O2、Na2CO3、CO2、NaOH,
故答案为:Na2CO3、CO2、NaOH;
(2)①钠和水反应生成NaOH和氢气,反应方程式为:2Na+2H2O=2NaOH+H2↑,
故答案为:2Na+2H2O=2NaOH+H2↑;
②过氧化钠和二氧化碳反应生成碳酸钠和氧气,反应方程式为:2Na2O2+2CO2=2Na2CO3+O2,故答案为:2Na2O2+2CO2=2Na2CO3+O2;
③钠在空气中加热生成过氧化钠,反应方程式为:2Na+O2![]() Na2O2。
Na2O2。


科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,可能发生的反应如下:
i. CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H1
CH3OH(g)+H2O(g) △H1
ii. CO2(g)+ H2(g)![]() CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
iii. CH3OH(g)![]() CO(g) +2H2(g) △H3
CO(g) +2H2(g) △H3
回答下列问题:
(1)已知反应ⅱ中相关化学键键能数据如下:

由此计算△H2=__________kJ·mol-1。已知△H3=99kJ·mol-1,则△H1=_________kJ·mol-1。
(2)一定比例的合成气在装有催化剂的反应器中反应12小时。体系中甲醇的产率和催化剂的催化活性与温度的关系如图1所示。

①温度为470K时,图中P点_______ (填“是”或“不是”)处于平衡状态。在490K之前,甲醇产率随着温度升高而增大的原因是_______;490K之后,甲醇产率下降的原因是_______。
②一定能提高甲醇产率的措施是______________。
A.增大压强 B,升高温度 C.选择合适催化剂 D.加入大量催化剂
(3)图2为一定比例的CO2/H2,CO/H2、CO/CO2/H2条件下甲醇生成速率与温度的关系。
①490K时,根据曲线a、c判断合成甲醇的反应机理是_________ (填“I”或“II")。
![]()
②490K时,曲线a与曲线b相比,CO的存在使甲醇生成速率增大,从热力学与动力学角度,并结合反应i、ⅱ分析原因_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四碘化锡(SnI4)是一种橙红色固体,熔点为144.5℃,沸点为364℃,易水解,易溶于有机溶剂,实验室通过如图所示装置用锡和碘单质制备SnI4,实验步骤如下:
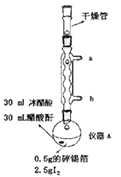
一、洗涤并干燥仪器,然后按照图中标注用量向仪器A中加入各种药品并组装仪器。
二、通入冷凝水,加热仪器A至装置中紫色蒸气消失,溶液颜色由紫红色变为橙红色。
三、停止加热,趁热过滤除去固体杂质,将滤液在烧杯中冷却析出晶体。
四、对所得晶体进行重结晶,过滤、洗涤、干燥、称量。
请回答下列相关问题:
(1)仪器A的名称是__________________,装置中球形冷凝管的作用是__________________,其效果优于直形冷凝管的原因是__________________。
(2)从实验步骤及装置图分析,实验过程中主要目的是防止SnI4水解的操作有___________、_______。
(3)若最终所得晶体的质量为2.2g,则锡的转化率为_______________(保留三位有效数字)。
(4)SnI4遇水发生复分解反应生成一种白色沉淀和一种强酸,检验反应后所得的溶液中的阴离子的常用方法有以下三种,请补充其中所缺试剂。
①沉淀法:稀硝酸和________________;②置换--萃取法;新制氯水和__________________;③利用该元素对应单质的某种特征反应:新制氯水和____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解装置如图所示,电解槽内装有 KI 及淀粉溶液,中间用阴离子交换膜 隔开.在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变 浅。已知:3I2+6OH﹣=IO3﹣+5I﹣+3H2O,下列说法不正确的是( )
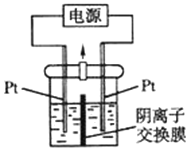
A. 右侧发生的电极反应式:2H2O+2e﹣=H2↑+2OH﹣
B. 电解结束后,右侧溶液中含有 IO3﹣
C. 电解槽内发生反应的总化学方程式:KI+3H2O![]() KIO3+3H2↑
KIO3+3H2↑
D. 如果用阳离子交换膜代替阴离子交换膜,电解槽内发生的总化学方程式不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】兴趣小组在实验室用制备的氯气与一氧化氮在常温常压下合成亚硝酰氯。
【查阅资料】 亚硝酰氯(NOCl,熔点:-64.5 ℃,沸点:-5.5 ℃) 是一种黄色气体,液体状态呈红褐色,遇水易水解。可用于合成清洁剂、触媒剂及中间体等。对眼睛、皮肤和粘膜有强烈刺激性,具有类似氯气和氮氧化物的毒作用。冰水中加入NaCl可降低温度。
【原料制备】 在实验室分别制备原料气NO和Cl2。
(1)用如下装置制备纯净干燥的气体,请补充下表中各仪器中的试剂。
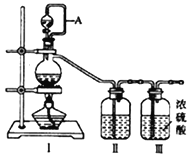
原料制备 | 装置Ⅰ | 装置Ⅰ | 装置Ⅱ |
烧瓶中 | 分液漏斗中 | ||
制备纯净Cl2 | MnO2 | ①__________ | ②______ |
制备纯净NO | Cu | ③_______ | ④_________ |
【合成亚硝酰氯】 利用制得的NO和Cl2制备NOCl,装置如图所示:
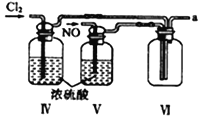
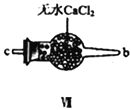
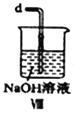
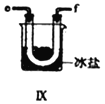
(2)装置Ⅳ、Ⅴ除可进一步干燥NO、Cl2外,另一个作用是___________________。
(3)装置连顺序为 a→_______________(按气流自左向右方向,用小写字母表示)。
(4)装置Ⅴ的作用是___________________________________。
(5)装置Ⅸ在实验时,预期观察到的现象是__________________________________________。
(6)装置Ⅷ中吸收尾气时,NOCl发生反应的化学方程式为________________________。
【拓展学习】
(7)查阅资料,得知配制王水(浓硝酸与浓盐酸的混酸) 时会生成亚硝酰氯和氯气,该反应的化学方程式为__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.苯和乙烷都能发生取代反应
B.石油的分馏和煤的干馏都是化学变化
C.工业上可通过石油分馏直接得到甲烷、乙烯和苯
D.乙烯和聚乙烯都能使溴的四氯化碳溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子检验的方法正确的是
A. 某溶液![]() 有白色沉淀,说明原溶液中有Cl-
有白色沉淀,说明原溶液中有Cl-
B. 某溶液![]() 有蓝色沉淀,说明原溶液中有Cu2+
有蓝色沉淀,说明原溶液中有Cu2+
C. 某溶液![]() 有白色沉淀,说明原溶液中有SO42-
有白色沉淀,说明原溶液中有SO42-
D. 某溶液![]() 生成无色气体,说明原溶液中有CO32-
生成无色气体,说明原溶液中有CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为维持人体血液中的血糖含量,在给病人输液时,通常用葡萄糖注射液。右图是医院病人输液使用的一瓶质量分数为5%的葡萄糖(C6H12O6)注射液标签,请认真观察标签上所列内容后列式计算(要求写出计算过程):

(1)该溶液的物质的量浓度为_________ mol·L-1(结果保留2位有效数字);
(2)该溶液的密度为__________ g·mL-1;
(3)如果从该瓶中取出75g葡萄糖注射液,将其变为15%的注射液,需要加入______g葡萄糖固体(质量精确到0.1g)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两个容积相同的容器中,一个盛有NH3,另一个盛有N2、H2的混合气体,在同温同压下,两容器内的气体一定具有相同的
A. 原子数 B. 分子数 C. 质量 D. 密度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com