
【题目】甲醇是重要的化工原料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,可能发生的反应如下:
i. CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H1
CH3OH(g)+H2O(g) △H1
ii. CO2(g)+ H2(g)![]() CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
iii. CH3OH(g)![]() CO(g) +2H2(g) △H3
CO(g) +2H2(g) △H3
回答下列问题:
(1)已知反应ⅱ中相关化学键键能数据如下:

由此计算△H2=__________kJ·mol-1。已知△H3=99kJ·mol-1,则△H1=_________kJ·mol-1。
(2)一定比例的合成气在装有催化剂的反应器中反应12小时。体系中甲醇的产率和催化剂的催化活性与温度的关系如图1所示。

①温度为470K时,图中P点_______ (填“是”或“不是”)处于平衡状态。在490K之前,甲醇产率随着温度升高而增大的原因是_______;490K之后,甲醇产率下降的原因是_______。
②一定能提高甲醇产率的措施是______________。
A.增大压强 B,升高温度 C.选择合适催化剂 D.加入大量催化剂
(3)图2为一定比例的CO2/H2,CO/H2、CO/CO2/H2条件下甲醇生成速率与温度的关系。
①490K时,根据曲线a、c判断合成甲醇的反应机理是_________ (填“I”或“II")。
![]()
②490K时,曲线a与曲线b相比,CO的存在使甲醇生成速率增大,从热力学与动力学角度,并结合反应i、ⅱ分析原因_________。
【答案】 36kJ·mol-1 -63kJ·mol-1 不是 温度越高化学反应速率越快 升高温度,反应i逆向移动,催化剂活性降低 AC Ⅱ CO促进反应Ⅱ逆向移动,二氧化碳和氢气的量增加,水蒸气的量减少
【解析】(1) CO2(g)+ H2(g)![]() CO(g)+H2O(g),反应热=反应物总键能-生成物总键能,故△H2=(2×803+436)kJ.mol-1-(1076kJ.mol-1+2×465kJ.mol-1)= 36kJ·mol-1;
CO(g)+H2O(g),反应热=反应物总键能-生成物总键能,故△H2=(2×803+436)kJ.mol-1-(1076kJ.mol-1+2×465kJ.mol-1)= 36kJ·mol-1;
根据盖斯定律:反应Ⅱ-反应Ⅰ=反应Ⅲ,故△H1=△H2-△H3=36kJ.mol-1-(99kJ.mol-1)=-63kJ.mol-1; ①温度为470K时,图中P点 不是处于平衡状态。在490K之前,甲醇产率随着温度升高而增大的原因是温度越高化学反应速率越快;490K之后,甲醇产率下降的原因是升高温度,反应i逆向移动,催化剂活性降低;②A.增大压强,反应Ⅰ平衡正向移动,故A正确; B,升高温度反应Ⅰ是放热反应,平衡逆向移动,故B错误; C.选择合适催化剂,选择生成甲醇,提高甲醇产率,故C正确; D.加入大量催化剂,不能影响平衡,故D错误;故选AC。(3)图2为一定比例的CO2/H2,CO/H2、CO/CO2/H2条件下甲醇生成速率与温度的关系。①490K时,从甲醇的生成速率来看,a曲线大于c曲线,即甲醇来源于CO2 和H2,故490K时,根据曲线a、c判断合成甲醇的反应机理是Ⅱ;②490K时,曲线a与曲线b相比,CO的存在使甲醇生成速率增大,从热力学与动力学角度,并结合反应i、ⅱ分析原因:对ii. CO2(g)+ H2(g)![]() CO(g)+H2O(g),CO是生成物,CO促进反应Ⅱ逆向移动,二氧化碳和氢气的量增加,水蒸气的量减少,i. CO2(g)+3H2(g)
CO(g)+H2O(g),CO是生成物,CO促进反应Ⅱ逆向移动,二氧化碳和氢气的量增加,水蒸气的量减少,i. CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) 正向进行,故CO的存在使甲醇生成速率增大。
CH3OH(g)+H2O(g) 正向进行,故CO的存在使甲醇生成速率增大。


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:
【题目】莫尔法是用硝酸银标准溶液测定卤离子含量的沉淀滴定法。某实验兴趣小组将无水FeC13与氯苯混合发生反应:2FeCl3+C6H5Cl![]() 2FeC12+C6H4C12+HC1↑,将生成的HC1用水吸收,利用莫尔法测出无水FeC13的转化率,同时得到常用的还原剂FeC12。按照如图装置,在三颈烧瓶中放入162.5g无水FeC13与225g氯苯,控制反应温度在130℃下加热3h,冷却、过滤、洗涤、干燥得到粗产品。有关数据如下:
2FeC12+C6H4C12+HC1↑,将生成的HC1用水吸收,利用莫尔法测出无水FeC13的转化率,同时得到常用的还原剂FeC12。按照如图装置,在三颈烧瓶中放入162.5g无水FeC13与225g氯苯,控制反应温度在130℃下加热3h,冷却、过滤、洗涤、干燥得到粗产品。有关数据如下:
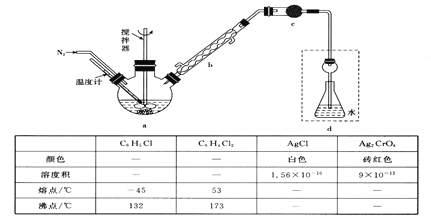
回答下列问题:
(1)仪器c的名称是_______________,盛装的试剂是___________________。
(2)仪器b球形冷凝管的作用是_________________________________。
(3)下列各装置(盛有蒸馏水)能代替图中虚线框内部分的是____________(填序号)。
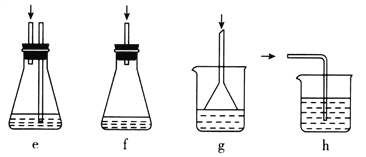
(4)如何从滤液中回收过量的氯苯:_______________________________________。
(5)将锥形瓶内的溶液稀释至1000mL,从中取10.00mL,滴加几滴K2CrO4作指示剂,用0.2000mol·L-1AgNO3溶液进行滴定,当达到终点时,消耗22.50mL AgNO3溶液。
①滴定终点的现象是________________________,使用棕色滴定管进行滴定的原因是________________________________________。
②无水FeC13的转化率![]() =__________%。
=__________%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今年在全球肆虐的禽流感又称为真性鸡瘟,包括中国在内的一些国家和地区发生了人类因感染禽流感病毒死亡的病例。据专家分析,该病毒中有70%-75%的化学成分为蛋白质,因此要重视高温杀毒.在56℃时加热30分钟,60℃时加热10分钟,70℃加热几分钟,阳光直射40-48小时均可杀死禽流感病毒。专家的上述建议是利用了蛋白质性质中的
A. 盐析 B. 变性 C. 水解 D. 颜色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,质量相同的CO2、H2、O2、CH4、SO2五种气体,下列说法错误的是( )
A. 所占的体积由大到小的顺序是: H2>CH4>O2>CO2>SO2
B. 所含的电子数由多到少是:CO2>SO2>CH4>O2>H2
C. 密度由大到小的顺序是:SO2>CO2>O2>CH4>H2
D. 所含分子数由多到少的顺序是:H2>CH4>O2>CO2>SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用铝锂钴废料(主要成分为Co3O4,还含有少量铝箔、LiCoO2等杂质)回收CoO的工艺流程如下:
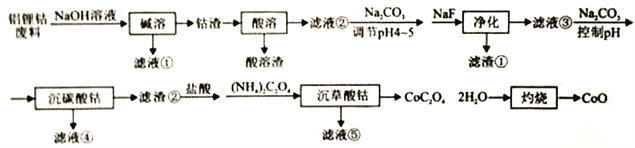
回答下列问题:
(1)“碱溶”的目的是:________________。
(2)不同浸出剂“酸溶”实验结果见下表,根据数据和物质性质应选择的浸出剂是___________(填序号),理由是__________ (用Co3O4参与反应的离子方程式表示)。
浸出剂 | 浸出液化学成分/(g·L-1) | 钴浸出率/% | |
Co | Al | ||
(a)HCI | 80.84 | 5.68 | 98.4 |
(b)H2SO4 | 65.0 | 6.22 | 72.3 |
(c)H2SO4+ Na2S2O3 | 84.91 | 5.96 | 98.0 |
(3)“净化”产生的滤渣为____________(填化学式),滤液③中c(F-)=4.0×10-3mol·L-1,则“净化”后残余c(Li+)=___________。LiF与Li2CO3的Ksp分别为1.8×10-3、1.7×10-3。
(4)若滤液④中含Co2+为5.9×10-2g·L-1,“沉碳酸钴"应控制pH不高于___________。Co(OH)2的Ksp为1.0×10-15。
(5)“沉碳酸钴“→“沉草酸钻”的目的是___________。
(6)CaC2O4·H2O在空气氛围中的热重曲线如下图。在311.96℃附近有个很强的放热峰的原因是______。900℃发生反应的化学方程式为___________。
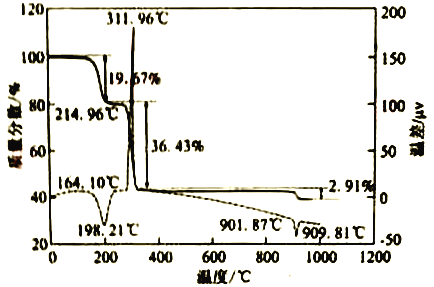
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列各题所给出的数据,得出的结论正确的是( )
A. 通入标准状况下 HCl 气体 11.2L,可使 1 L 浓度为 0.5mol/L 的盐酸物质的量浓度增大到 1mol/L
B. 在 10%的 NaOH 溶液中,平均每 9 个水分子溶有 1 个 OH-
C. 将 10g 碳酸钙粉末加水配成 100ml 溶液,CaCO3 物质的量浓度为 1mol/L
D. 4g NaOH 溶解在 10mL 水中,再稀释成 1L,从中取 1mL,这 1mL 溶液的物质的量浓度为 0.1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用活性炭还原法处理氮氧化物。有关反应为C(s)+2NO(g)![]() N2(g)+ CO2(g) △H=akJ/mol。某研究小组向某恒容密闭容器中加入一定量的活性炭和NO,恒温(T1℃)条件下反应,已知在不同时间测得各物质的浓度如下:
N2(g)+ CO2(g) △H=akJ/mol。某研究小组向某恒容密闭容器中加入一定量的活性炭和NO,恒温(T1℃)条件下反应,已知在不同时间测得各物质的浓度如下:
| 0 | 10 | 20 | 30 | 40 | 50 |
NO | 0.100 | 0.076 | 0.060 | 0.060 | 0.050 | 0.050 |
N2 | 0 | 0.012 | 0.020 | 0.020 | 0.025 | 0.025 |
CO2 | 0 | 0.012 | 0.020 | 0.020 | 0.011 | 0.011 |
(1
(2)30s后,改变某一条件,反应重新达到平衡,则改变的条件可能是________,若30s后升高温度至T2℃,平衡时,容器中NO的浓度由0.060mol/L变为0.072mol/L,则该反应的a___0 (填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某银白色金属单质A在空气中加热燃烧时发出黄色火焰,得到淡黄色固体B,A暴露在空气中足够长时间变为C,B和酸性气体D能生成C,A和B都能与水生成E,E和D也能生成C。回答下列问题。
(1)写出下列物质的化学式:C_____________,D_____________,E_____________。
(2)写出下列反应的化学方程式:
①A和水生成E:______________________________________________________;
②B和D生成C:______________________________________________________;
③A在空气中加热:___________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com