
【题目】目前最有发展前景的一次性餐具是( )
A.瓷器餐具
B.淀粉餐具
C.塑料餐具
D.纸木餐具
 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:
【题目】某二元酸H2A在水中的电离方程式是H2A = H+ + HA﹣,HA﹣![]() H+ + A2﹣.回答下列问题:
H+ + A2﹣.回答下列问题:
(1)Na2A溶液显______________(填“酸性”、“中性”或“碱性”),理由是________________________________(用离子方程式或必要的文字说明).
(2)常温下,已知0.1molL﹣1NaHA溶液pH=2,则0.1molL﹣1H2A溶液中氢离子的物质的量浓度可能______0.11molL﹣1(填“大于”、“等于”或“小于”),理由是_____________________.
(3)0.1molL﹣1NaHA溶液中各种离子浓度由大到小的顺序是_________.
(4)Na2A溶液中,下列表述正确的是_________.
A.c(Na+) + c(H+)= c(HA﹣)+ 2c(A2﹣)+ c(OH﹣)
B. c(OH﹣)= c(HA﹣)+ c(H+)
C.c(OH﹣)= c(HA﹣)+ c(H+)+ 2c(H2A)
D.c (Na+)= 2[c(HA﹣)+ c(A2﹣) + c(H2A)]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用 NA 表示阿伏加德罗常数的值,下列说法错误的是( )
A. 标准状况下,22.4L 由 N2 和 N2O 组成的混合气体中,所含有的氦原子的物质的量为 2mol
B. 1.7g NH3 含有的质子数为 NA
C. 标准状况下,11.2L 氦气和氢气的混合气含有的分子数为 0.5NA
D. 1L 0.1mol/LCH3CH2OH 水溶液中含 H 原子数目为 0.6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,可能发生的反应如下:
i. CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H1
CH3OH(g)+H2O(g) △H1
ii. CO2(g)+ H2(g)![]() CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
iii. CH3OH(g)![]() CO(g) +2H2(g) △H3
CO(g) +2H2(g) △H3
回答下列问题:
(1)已知反应ⅱ中相关化学键键能数据如下:

由此计算△H2=__________kJ·mol-1。已知△H3=99kJ·mol-1,则△H1=_________kJ·mol-1。
(2)一定比例的合成气在装有催化剂的反应器中反应12小时。体系中甲醇的产率和催化剂的催化活性与温度的关系如图1所示。

①温度为470K时,图中P点_______ (填“是”或“不是”)处于平衡状态。在490K之前,甲醇产率随着温度升高而增大的原因是_______;490K之后,甲醇产率下降的原因是_______。
②一定能提高甲醇产率的措施是______________。
A.增大压强 B,升高温度 C.选择合适催化剂 D.加入大量催化剂
(3)图2为一定比例的CO2/H2,CO/H2、CO/CO2/H2条件下甲醇生成速率与温度的关系。
①490K时,根据曲线a、c判断合成甲醇的反应机理是_________ (填“I”或“II")。
![]()
②490K时,曲线a与曲线b相比,CO的存在使甲醇生成速率增大,从热力学与动力学角度,并结合反应i、ⅱ分析原因_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,属于加成反应的是( )
A.乙烯使溴水褪色
B.将苯滴入溴水中,振荡后水层接近无色
C.乙烯使酸性KMnO4溶液褪色
D.甲烷与氯气混合,光照后黄绿色消失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,某容积固定的密闭容器由可移动的活塞隔成左、右两室,左室充入等物质的量的氢气和氧气,右室充入一氧化碳和氧气的混合气。同时引燃左右两室的混合气,反应后恢复到室温。反应前后活塞位置如下图所示,则右室混合气体中一氧化碳和氧气的物质的量之比可能是(液态水的体积忽略不计)

①1:1 ②1:2 ③1:3 ④3:1
A. ①② B. ②④ C. ①④ D. ①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四碘化锡(SnI4)是一种橙红色固体,熔点为144.5℃,沸点为364℃,易水解,易溶于有机溶剂,实验室通过如图所示装置用锡和碘单质制备SnI4,实验步骤如下:
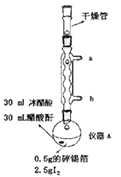
一、洗涤并干燥仪器,然后按照图中标注用量向仪器A中加入各种药品并组装仪器。
二、通入冷凝水,加热仪器A至装置中紫色蒸气消失,溶液颜色由紫红色变为橙红色。
三、停止加热,趁热过滤除去固体杂质,将滤液在烧杯中冷却析出晶体。
四、对所得晶体进行重结晶,过滤、洗涤、干燥、称量。
请回答下列相关问题:
(1)仪器A的名称是__________________,装置中球形冷凝管的作用是__________________,其效果优于直形冷凝管的原因是__________________。
(2)从实验步骤及装置图分析,实验过程中主要目的是防止SnI4水解的操作有___________、_______。
(3)若最终所得晶体的质量为2.2g,则锡的转化率为_______________(保留三位有效数字)。
(4)SnI4遇水发生复分解反应生成一种白色沉淀和一种强酸,检验反应后所得的溶液中的阴离子的常用方法有以下三种,请补充其中所缺试剂。
①沉淀法:稀硝酸和________________;②置换--萃取法;新制氯水和__________________;③利用该元素对应单质的某种特征反应:新制氯水和____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子检验的方法正确的是
A. 某溶液![]() 有白色沉淀,说明原溶液中有Cl-
有白色沉淀,说明原溶液中有Cl-
B. 某溶液![]() 有蓝色沉淀,说明原溶液中有Cu2+
有蓝色沉淀,说明原溶液中有Cu2+
C. 某溶液![]() 有白色沉淀,说明原溶液中有SO42-
有白色沉淀,说明原溶液中有SO42-
D. 某溶液![]() 生成无色气体,说明原溶液中有CO32-
生成无色气体,说明原溶液中有CO32-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com