
【题目】室温下,某容积固定的密闭容器由可移动的活塞隔成左、右两室,左室充入等物质的量的氢气和氧气,右室充入一氧化碳和氧气的混合气。同时引燃左右两室的混合气,反应后恢复到室温。反应前后活塞位置如下图所示,则右室混合气体中一氧化碳和氧气的物质的量之比可能是(液态水的体积忽略不计)

①1:1 ②1:2 ③1:3 ④3:1
A. ①② B. ②④ C. ①④ D. ①③
【答案】C
【解析】反应前,活塞处于容器的中间,左右两室的气体的物质的量相等,因为氢气和氧气的物质的量相等,设氢气和氧气的物质的量均为2mol,所以一氧化碳和氧气的总物质的量也为4mol。反应后根据2H2+O2![]() 2H2O,可知氢气过量1mol,并且右室中的气体的物质的量是左室中气体物质的量的3倍,所以右室中有3mol气体。设CO的物质的量为xmol,则O2的物质的量为(4-x )mol,2CO+O2
2H2O,可知氢气过量1mol,并且右室中的气体的物质的量是左室中气体物质的量的3倍,所以右室中有3mol气体。设CO的物质的量为xmol,则O2的物质的量为(4-x )mol,2CO+O2![]() 2CO2 ,当CO过量时,O2全部反应,剩余气体的物质的量n=2×(4-x ) +x-2×(4-x ) =3,解得x=3,即CO的物质的量为3mol,则O2的物质的量为1mol,CO与O2的物质的量之比为3:1;当CO全部反应,O2有剩余时,根据方程式有:x+(4-x)-x/2=3,解得x=2,即CO的物质的量为2mol,则O2的物质的量也为2mol,两者物质的量之比为1:1,所以①④正确,答案选C。正确答案为C
2CO2 ,当CO过量时,O2全部反应,剩余气体的物质的量n=2×(4-x ) +x-2×(4-x ) =3,解得x=3,即CO的物质的量为3mol,则O2的物质的量为1mol,CO与O2的物质的量之比为3:1;当CO全部反应,O2有剩余时,根据方程式有:x+(4-x)-x/2=3,解得x=2,即CO的物质的量为2mol,则O2的物质的量也为2mol,两者物质的量之比为1:1,所以①④正确,答案选C。正确答案为C


 每课必练系列答案
每课必练系列答案科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A. 硫酸氢钠溶液中加入氢氧化钡溶液至溶液呈中性:2H++SO42++Ba2++2OH-=BaSO4↓+2H2O
B. 澄清石灰水与过量碳酸氢钠溶液反应: HCO3-+Ca2++OH-=CaCO3↓+H2O
C. 金属钠和水发生反应: Na+H2O=Na++OH-+H2↑
D. 向AlCl3溶液中加入过量的氨水溶液: Al3++3OH-=Al(OH)3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据Zn+2H+===Zn2++H2↑的反应原理设计一个原电池,当锌为负极时,正极可以选用的金属材料是( )
A. 镁 B. 石墨 C. 铝 D. 铅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知N2(g)+3H2(g)![]() 2NH3(g) ΔH=92.4 kJ·mol1。请回答:
2NH3(g) ΔH=92.4 kJ·mol1。请回答:
(1)合成氨工业中采取的下列措施可以用勒夏特列原理解释的是______(填字母)。
a.用铁作催化剂加快化学反应速率
b.采用较高压强(20 Mpa~50 MPa)
c.增大N2的浓度提高H2的转化率
d.合成氨时采用循环操作
e.加热到500℃
(2)合成氨反应达到平衡时,用H2表示的正反应速率为v正(H2),用NH3表示的逆反应速率为v逆(NH3),二者满足的关系式为_______________。
(3)当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如图所示。图中tl时引起平衡移动的条件可能是____________。其中表示平衡混合物中NH3的含量最高的一段时间是____________。

(4)温度为T℃时,将2 mol H2和1 mol N2加入0.5 L密闭容器中,充分反应后测得N2的转化率为50%。则平衡时H2的浓度为____________。
(5)当温度升高时,反应的化学平衡常数K值_________(填“增大”“减小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在强酸性溶液中,下列离子组能大量共存且为无色透明的是( )
A.Na+、K+、OH-、Cl-B.Na+、Cu2+、SO42-、NO3-
C.Mg2+、Na+、SO42-、Cl-D.Ba2+、K+、Fe2+、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【加试题】已知化合物A能使紫色石蕊试液变红,化合物F合成路线如下:
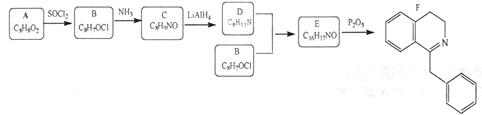
已知:![]()
(1)B→C的反应类型是_______________。
(2)下列说法不正确的是____________________。
A.化合物A含有羧基 B.化合物B能使酸性高锰酸钾溶液褪色
C.化合物D能与盐酸反应 D.化合物E具有联苯结构
(3)写出E→F的化学反应方程式_____________。
(4)已知:
①![]() ②
②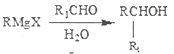 ③
③ ![]()
设计以氯苯和简单有机物(不超过两个碳原子)为原料制备A的合成路线(用流程图表示,无机试剂任选)___________。
(5)写出同时符合下列条件的E的同分异构体的结构简式(任写出两种)________________。
①分子中有两个苯环②![]() H-NMR谱表明分子中有5种氢原子③能发生银镜反应
H-NMR谱表明分子中有5种氢原子③能发生银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁元素在地壳中含量丰富,下列有关说法正确的是( )
A.铁合金是我国使用最早的合金
B.可用铁制品盛放冷的浓硫酸
C.向某溶液中加入KSCN,溶液变为血红色,说明该溶液中含有Fe2+
D.Fe(OH)3不能通过化合反应制得
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《科学美国人》评出2016年十大创新技术:碳呼吸电池、量子卫星、万能抗病毒药……,“碳呼吸电池”是一种新型能源装置,其工作原理如图。下列有关说法错误的是( )

A. 该装置是将化学能转变为电能
B. 金属铝是负极,多孔碳是正极
C. 正极的电极反应为2CO2-2e-=C2O42-
D. 将电池配备在火力发电站和汽车排气管上,不但可减少 CO2排放,而且还可以利用CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)X、Y、Z三种液体的近似pH如图,下列判断正确的是___________。

A.X一定是酸或强酸弱碱盐溶液 B.Y一定是90℃时的纯水
C.Y液体一定呈中性 D.Z可能是Na2SiO3溶液
(2)物质的量浓度相同的三种溶液:①NH4Cl②氨水③NH4HSO4,c(NH4+)大小顺序正确的
是___________。
A.①>②>③ B.③>①>② C.②>③>① D.③>②>①
(3)用铂电极电解一定浓度的下列物质的水溶液,在电解后的溶液中加适量水,能使溶液浓度恢复到电解前浓度的是___________。
A.NaOH B.CuSO4C.K2S D.NaCl
(4)比较填空(选填“>"或“ <"或"=”)
①2H2(g)+O2(g)= 2H2O(g)△H1和2H2(g)+O2(g)= 2H2O(l)△H2的△H大小:△H1 __________△H2。
②等体积等PH的溶液:a.盐酸 b.硫酸,分別与足量NaOH溶液反应,消耗NaOH的物质的
量多少:a___________b。
③常温下两种溶液:a.pH=4盐酸 b.pH=4NH4Cl溶液,其中水的电离程度大小:a__________b。
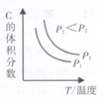
④已知某可逆反应aA(g)+bB(g)![]() cC(g)+dD(g)。当其它条件不变时,C的体积分数与温度(T)和压强(P)的关系如右图所示,则反应物和生成物的化学计量数之和:a+b ______c+d。
cC(g)+dD(g)。当其它条件不变时,C的体积分数与温度(T)和压强(P)的关系如右图所示,则反应物和生成物的化学计量数之和:a+b ______c+d。
(5)在一定体积的密闭容器中加入1molCO2和1mol H2,进行如下化学反应:CO2(g)+ H2(g) ![]() CO(g)+H2O(g) ,其化学平衡常数K和温度T的关系如下表:
CO(g)+H2O(g) ,其化学平衡常数K和温度T的关系如下表:
T(℃) | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
①该反应的化学平衡常数表达式为K=__________________________。
②反应为___________反应(填“吸热”或“放热”)。
③某温度下,平衡时各物质的浓度有如下关系:3[c(CO2)c(H2)] =5[c(CO)(H2O)],判断此时的反应温度为___________℃。
④800℃,向容器内充入lmolCO2、lmolH2、lmol CO、lmolH2O,此刻反应的v正___________ v逆(填“>"或“<”或“=”)
(6)下图所示为用惰性电极电解100mL 0.5mol·CuSO4溶液的装置,b电极上的电极反应式为______。若a电极共产生56mL(标准状况)气体,则所得溶液的pH =___________(不考虑溶液体积变化)。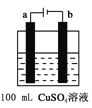
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com