
【题目】铁元素在地壳中含量丰富,下列有关说法正确的是( )
A.铁合金是我国使用最早的合金
B.可用铁制品盛放冷的浓硫酸
C.向某溶液中加入KSCN,溶液变为血红色,说明该溶液中含有Fe2+
D.Fe(OH)3不能通过化合反应制得
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】目前,我国的能源结构主要是煤,还有石油、天然气等化石燃料,这些都是不可再生且污染环境的能源,研究和开发清洁而又用之不竭的能源是未来发展的重要任务。科学家预测“氢能”将是21世纪最理想的新能源之一。
(1)某学生查阅大量资料,提出下列“用水制取氢气的研究方向”:
①在水不发生化学反应的情况下制取氢气,同时释放能量
②设法将太阳光聚焦,产生高温,使水分解产生氢气
③寻找高效催化剂,大力提高水在一定条件下分解产生氢气的转化率
④寻找特殊化学物质,以提高单位时间内水分解制取氢气的产量
请你选择上述研究方向中不正确的一项,并简述其理由:不正确的一项是 ,理由是 。
(2)工业上用甲烷制取氢气时发生的两步反应的能量变化如下图所示:

①第Ⅱ步反应为可逆反应,在此反应中,增加H2O(g)的浓度,CO的转化率将 (填“增大”“减小”或“不变”);该反应的平衡常数表达式为K= 。在800 ℃时,若CO的起始浓度为2.0 mol/L,水蒸气的起始浓度为3.0 mol/L,达到化学平衡状态后,测得CO2的浓度为1.2 mol/L,则此反应的平衡常数K= ,CO的平衡转化率为 。
②甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式是 。
(3)科学研究发现纳米级的Cu2O可作为太阳光分解水的催化剂。取四份用不同方法制得的相同质量的Cu2O,在某同等条件下分别对四份相同质量的水催化分解,产生的氢气经干燥后用针筒收集。V(H2)随时间的变化如图所示。下列叙述正确的是 。

A.用d法制得的Cu2O能使水剧烈分解并放出热量
B.用d法制得的Cu2O颗粒最小,表面活性大,所以催化效果明显
C.用c法、d法制得的Cu2O作催化剂,产生氢气的总体积不同可能和水的蒸发有关
D.用a法、b法制得的Cu2O中可能含有较多的CuO杂质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,某容积固定的密闭容器由可移动的活塞隔成左、右两室,左室充入等物质的量的氢气和氧气,右室充入一氧化碳和氧气的混合气。同时引燃左右两室的混合气,反应后恢复到室温。反应前后活塞位置如下图所示,则右室混合气体中一氧化碳和氧气的物质的量之比可能是(液态水的体积忽略不计)

①1:1 ②1:2 ③1:3 ④3:1
A. ①② B. ②④ C. ①④ D. ①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
相对分子质量为92的某芳香烃X是一种重要的有机化工原料,研究部门以它为初始原料设计出如下转化关系图(部分产物、合成路线、反应条件略去)。其中A是一氯代物,H是一种功能高分子,链节组成为C7H5NO。

已知:
Ⅰ. ![]()
Ⅱ. ![]() (苯胺、易被氧化)
(苯胺、易被氧化)
请根据所学知识与本题所给信息回答下列问题:
(1)X的分子式是__________;C的名称是___________。
(2)H的结构简式是_____________。
(3)反应②、④的类型是__________。
(4)反应⑤的化学方程式是____________;
(5) 有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物共有_______种。
有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物共有_______种。
(6)请用合成反应流程图表示出由A和其他无机物(溶剂任选)合成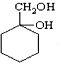 最合理的方案。
最合理的方案。
示例如下:

____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制备干燥的氨气所需的药品是( )
A. 饱和氨水、浓硫酸 B. NH4Cl稀溶液、NaOH稀溶液、碱石灰
C. NaOH溶液、NH4Cl晶体、浓H2SO4 D. NH4Cl固体、消石灰、碱石灰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸钠铝[NaaAlb(OH)c(CO3)d]可用作阻燃剂、抗酸剂等。其制备方法是:控制温度、pH,向NaHCO3稀溶液中加入Al(OH)3,并搅拌,充分反应后过滤、洗涤、干燥,得碱式碳酸钠铝。
(1)碱式碳酸钠铝[NaaAlb(OH)c(CO3)d]中a、b、c、d之间的关系为________。
(2)碱式碳酸钠铝作为阻燃剂的可能原因:①在分解过程中大量吸热;②本身及产物无毒且不可燃;③________________________。
(3)若pH过高,则对产品的影响是________________________。
(4)为确定碱式碳酸钠铝的组成,进行如下实验:
①准确称取2.880 g样品用足量稀硝酸溶解,得到CO2 0.448 L(已换算成标准状况下),并测得溶液中含有0.02 mol Al3+。
②加热至340 ℃以上时样品迅速分解,得到金属氧化物、CO2和H2O。当样品分解完全时,样品的固体残留率(固体样品的剩余质量/固体样品的起始质量×100%)为56.9%,根据以上实验数据确定碱式碳酸钠铝的组成(写出计算过程)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com