
【题目】能说明二氧化硫具有还原性的事实是
A. 使品红溶液褪色 B. 使溴水褪色
C. 与氢硫酸反应 D. 与烧碱反应
 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:
【题目】铁元素在地壳中含量丰富,下列有关说法正确的是( )
A.铁合金是我国使用最早的合金
B.可用铁制品盛放冷的浓硫酸
C.向某溶液中加入KSCN,溶液变为血红色,说明该溶液中含有Fe2+
D.Fe(OH)3不能通过化合反应制得
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铁片与稀硫酸反应制取氢气时,下列措施能使氢气生成速率加大的是( )
A. 加少量CH3COONa固体 B. 加硝酸钾固体
C. 不用铁片,改用铁粉 D. 不用稀硫酸,改用98%浓硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)X、Y、Z三种液体的近似pH如图,下列判断正确的是___________。

A.X一定是酸或强酸弱碱盐溶液 B.Y一定是90℃时的纯水
C.Y液体一定呈中性 D.Z可能是Na2SiO3溶液
(2)物质的量浓度相同的三种溶液:①NH4Cl②氨水③NH4HSO4,c(NH4+)大小顺序正确的
是___________。
A.①>②>③ B.③>①>② C.②>③>① D.③>②>①
(3)用铂电极电解一定浓度的下列物质的水溶液,在电解后的溶液中加适量水,能使溶液浓度恢复到电解前浓度的是___________。
A.NaOH B.CuSO4C.K2S D.NaCl
(4)比较填空(选填“>"或“ <"或"=”)
①2H2(g)+O2(g)= 2H2O(g)△H1和2H2(g)+O2(g)= 2H2O(l)△H2的△H大小:△H1 __________△H2。
②等体积等PH的溶液:a.盐酸 b.硫酸,分別与足量NaOH溶液反应,消耗NaOH的物质的
量多少:a___________b。
③常温下两种溶液:a.pH=4盐酸 b.pH=4NH4Cl溶液,其中水的电离程度大小:a__________b。
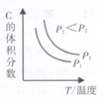
④已知某可逆反应aA(g)+bB(g)![]() cC(g)+dD(g)。当其它条件不变时,C的体积分数与温度(T)和压强(P)的关系如右图所示,则反应物和生成物的化学计量数之和:a+b ______c+d。
cC(g)+dD(g)。当其它条件不变时,C的体积分数与温度(T)和压强(P)的关系如右图所示,则反应物和生成物的化学计量数之和:a+b ______c+d。
(5)在一定体积的密闭容器中加入1molCO2和1mol H2,进行如下化学反应:CO2(g)+ H2(g) ![]() CO(g)+H2O(g) ,其化学平衡常数K和温度T的关系如下表:
CO(g)+H2O(g) ,其化学平衡常数K和温度T的关系如下表:
T(℃) | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
①该反应的化学平衡常数表达式为K=__________________________。
②反应为___________反应(填“吸热”或“放热”)。
③某温度下,平衡时各物质的浓度有如下关系:3[c(CO2)c(H2)] =5[c(CO)(H2O)],判断此时的反应温度为___________℃。
④800℃,向容器内充入lmolCO2、lmolH2、lmol CO、lmolH2O,此刻反应的v正___________ v逆(填“>"或“<”或“=”)
(6)下图所示为用惰性电极电解100mL 0.5mol·CuSO4溶液的装置,b电极上的电极反应式为______。若a电极共产生56mL(标准状况)气体,则所得溶液的pH =___________(不考虑溶液体积变化)。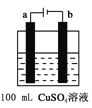
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学研究合成氨反应及氨水的性质如下:
(1)已知:N2(g)+3H2(g)=2NH3(g) △H =-92.4 kJ/mol
2H2(g)+O2(g)=2H2O(g) △H =-483.6kJ/mol
则氨气完全燃烧生成氮气和水蒸气的热化学方程式__________________________。
(2)如图是合成氨反应平衡混合气中NH3的体积分数随温度或压强变化的曲线,图中L(L1、L2)、X分别代表温度或压强。其中X代表的是_______________(填“温度”或“压强”),判断L1、L2的大小关系:L1______L2(填“<”或“>”)。

(3)已知:在硫酸铜溶液中加入浓氨水,首先析出蓝色的碱式硫酸铜沉淀,氨水过量时此沉淀溶解,得到深蓝色的四氨合铜(Ⅱ)络离子,发生的离子反应如下:
a.2Cu2++ 2NH3·H2O+ SO42-=== 2NH4+ + Cu2(OH)2SO4↓
b.Cu2(OH)2SO4 + 8 NH3![]() 2[Cu(NH3)4]2++SO42-+2 OH-
2[Cu(NH3)4]2++SO42-+2 OH-
某小组设计如下实验:

①试管ⅰ中反应的离子方程式_______________________________________。
②试管ⅱ中的深蓝色晶体是[Cu(NH3)4]SO4·H2O,该实验现象反映出该晶体的性质是______。
③请结合方程式解释试管ⅲ加入少量NaOH后产生蓝色沉淀和气体的原因_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向容积为2 L的密闭容器中通入两种气体,发生化学反应,反应中各物质的物质的量变化如下图所示,对该反应的推断合理的是

A. 该反应的化学方程式为3B+4D![]() 6A+2C
6A+2C
B. 反应进行到1 s时,v(A)=v(D)
C. 反应进行到6 s时,B的平均反应速率为0.05 mol·L-1·s-1
D. 反应进行到6 s时,各物质的反应速率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一包白色粉末,由BaCl2、K2SO4、CaCO3、NaOH、CuSO4中的一种或几种组成,为了探究它的成份,进行了如下实验:下列判断正确的是( )

A. BaCl2,CaCO3一定存在,NaOH可能存在
B. K2SO4、CuSO4一定不存在
C. K2SO4、NaOH、CaCO3、BaCl2一定存在,CuSO4可能存在
D. C为单一溶质溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【题目】NA为阿伏加德罗常数的值。下列说法不正确的是
A. 5.6gFe在0.1molCl2中充分燃烧,转移的电子数为0.2NA
B. 常温下,1L0.1mol/L的NH4NO3溶液中氮原子数为0.2NA
C. 50mL12molL-1盐酸与足量MnO2共热,转移的电子数为0.3NA
D. 0.1mol H2和0.1mol I2于密闭容器中充分反应后,其分子总数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纸电池是一种广泛应用的“软电池”,如图这种碱性电池采用薄层纸片作为载体和传导体,纸的两面分别附着锌和二氧化锰。下列有关该纸电池说法不合理的是

A.Zn为负极,进行氧化反应
B.电池工作时,电子由MnO2流向Zn
C.正极反应:MnO2+e-+H2O═MnO(OH)+OH-
D.电池总反应:Zn+2MnO2+2H2O═Zn(OH)2+2MnO(OH)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com