
����Ŀ��ij��Ԫ��H2A��ˮ�еĵ��뷽��ʽ��H2A = H+ + HA����HA��![]() H+ + A2�����ش��������⣺
H+ + A2�����ش��������⣺
��1��Na2A��Һ��______________������ԡ��������ԡ����ԡ�����������________________________________�������ӷ���ʽ���Ҫ������˵������
��2�������£���֪0.1molL��1NaHA��ҺpH=2����0.1molL��1H2A��Һ�������ӵ����ʵ���Ũ�ȿ���______0.11molL��1������ڡ��������ڡ���С�ڡ�����������_____________________��
��3��0.1molL��1NaHA��Һ�и�������Ũ���ɴ�С��˳����_________��
��4��Na2A��Һ�У����б�����ȷ����_________��
A��c��Na+�� + c(H+��= c��HA����+ 2c��A2����+ c��OH����
B. c��OH����= c��HA����+ c��H+��
C��c��OH����= c��HA����+ c��H+��+ 2c��H2A��
D��c (Na+��= 2��c��HA����+ c(A2��) + c(H2A����
���𰸡� ���� A2���� H2O ![]() HA����OH�� , ��A2��ˮ���Լ��� С�� H2A���������H+���Ƶ�HA������ c(Na��)��c(HA��)��c(H��)��c(A2��)>c(OH��) AB
HA����OH�� , ��A2��ˮ���Լ��� С�� H2A���������H+���Ƶ�HA������ c(Na��)��c(HA��)��c(H��)��c(A2��)>c(OH��) AB
�����������⿼������ˮ����ɼ�������Ũ�ȴ�С�ıȽϹ�ϵ����1������H2A�ĵ����Ƿֲ��������֪��H2A��ǿ�ᣬHA-�����ᣬ����Na2A��Һ�Լ��ԣ�����A2��ˮ���Լ��ԣ�ˮ��ԭ���ǣ�A2���� H2O ![]() HA����OH������2��0.1molL-1H2A��Һ��H2A�TH++HA-�������0.1mol/LH+��0.1molL-1NaHA��Һ��pH=2������HA-H++A2-��֪�������0.01mol/LH+����H2A��һ���������ɵ�H+������HA-�ĵ��룬������Һ�������ӵ����ʵ���Ũ��С��0.1mol/L+0.01mol/L����3��NaHA��Һ�����ԣ�����H2A�TH++HA-����c��Na+����c��HA-����c��H+����c��OH-�������ˮ�ĵ���H2OH++OH-��ͬʱ�в���A2-����ˮ�⣬ʹc��A2-����С������c��H+����c��A2-������NaHA��Һ�и�������Ũ���ɴ�С��˳��Ϊc(Na��)��c(HA��)��c(H��)��c(A2��)>c(OH��)����4��c��Na+��+ c(H+��= c��HA����+ 2c��A2����+ c��OH������ʾNa2A��Һ�еĵ���غ㣬A����ȷ��c��OH����= c��HA����+ c��H+����ʾNa2A��Һ�е������غ㣬B����ȷ��C�������A��B��ӵ�c (Na+��= 2��c��HA����+ c(A2��)�ݣ�D�����
HA����OH������2��0.1molL-1H2A��Һ��H2A�TH++HA-�������0.1mol/LH+��0.1molL-1NaHA��Һ��pH=2������HA-H++A2-��֪�������0.01mol/LH+����H2A��һ���������ɵ�H+������HA-�ĵ��룬������Һ�������ӵ����ʵ���Ũ��С��0.1mol/L+0.01mol/L����3��NaHA��Һ�����ԣ�����H2A�TH++HA-����c��Na+����c��HA-����c��H+����c��OH-�������ˮ�ĵ���H2OH++OH-��ͬʱ�в���A2-����ˮ�⣬ʹc��A2-����С������c��H+����c��A2-������NaHA��Һ�и�������Ũ���ɴ�С��˳��Ϊc(Na��)��c(HA��)��c(H��)��c(A2��)>c(OH��)����4��c��Na+��+ c(H+��= c��HA����+ 2c��A2����+ c��OH������ʾNa2A��Һ�еĵ���غ㣬A����ȷ��c��OH����= c��HA����+ c��H+����ʾNa2A��Һ�е������غ㣬B����ȷ��C�������A��B��ӵ�c (Na+��= 2��c��HA����+ c(A2��)�ݣ�D�����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ӣ�Ni-Cd���ɳ�������ִ��������й㷺Ӧ�á���֪ij���ӵ�صĵ������ҺΪKOH��Һ����䡢�ŵ簴��ʽ���У�Cd + 2NiOOH + 2H2O![]() Cd(OH)2 + 2Ni(OH)2���йظõ�ص�˵����ȷ����
Cd(OH)2 + 2Ni(OH)2���йظõ�ص�˵����ȷ����
A. ���ʱ������Ӧ��Ni(OH)2 ��e�� + OH- == NiOOH + H2O
B. �������ǻ�ѧ��ת��Ϊ���ܵĹ���
C. �ŵ�ʱ����������Һ�ļ��Բ���
D. �ŵ�ʱ�������Һ�е�OH-�������ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ī������������������Һ�ⶨ±���Ӻ����ij����ζ�����ijʵ����ȤС�齫��ˮFeC13���ȱ���Ϸ�����Ӧ��2FeCl3+C6H5Cl![]() 2FeC12+C6H4C12+HC1���������ɵ�HC1��ˮ���գ�����Ī���������ˮFeC13��ת���ʣ�ͬʱ�õ����õĻ�ԭ��FeC12��������ͼװ�ã���������ƿ�з���162��5g��ˮFeC13��225g�ȱ������Ʒ�Ӧ�¶���130���¼���3h����ȴ�����ˡ�ϴ�ӡ�����õ��ֲ�Ʒ���й��������£�
2FeC12+C6H4C12+HC1���������ɵ�HC1��ˮ���գ�����Ī���������ˮFeC13��ת���ʣ�ͬʱ�õ����õĻ�ԭ��FeC12��������ͼװ�ã���������ƿ�з���162��5g��ˮFeC13��225g�ȱ������Ʒ�Ӧ�¶���130���¼���3h����ȴ�����ˡ�ϴ�ӡ�����õ��ֲ�Ʒ���й��������£�
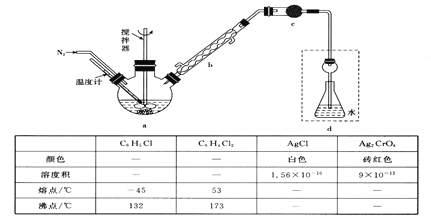
�ش��������⣺
(1)����c��������_______________��ʢװ���Լ���___________________��
(2)����b���������ܵ�������_________________________________��
(3)���и�װ��(ʢ������ˮ)�ܴ���ͼ�����߿��ڲ��ֵ���____________(�����)��
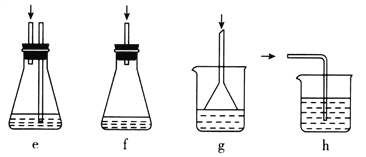
(4)��δ���Һ�л��չ������ȱ���_______________________________________��
(5)����ƿ�ڵ���Һϡ����1000mL������ȡ10��00mL���μӼ���K2CrO4��ָʾ������0.2000mol��L-1AgNO3��Һ���еζ������ﵽ�յ�ʱ������22.50mL AgNO3��Һ��
�ٵζ��յ��������________________________��ʹ����ɫ�ζ��ܽ��еζ���ԭ����________________________________________��
����ˮFeC13��ת����![]() =__________%��
=__________%��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������H2C2O4��ʾ��Ϊ�˲ⶨij������Һ��Ũ�ȣ���������ʵ�飺��ȡWg���ᾧ�壬���100.00mLˮ��Һ��ȡ25.00mL�����ƵIJ�����Һ������ƿ�ڣ���������ϡH2SO4����Ũ��ΪamolL��1��KMnO4��Һ�ζ���KMnO4������ɫΪֹ���������ķ�ӦΪ��2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2��+2MnSO4+8H2O��
�Իش�
��1��ʵ���У���ҺKMnO4��ҺӦװ��_____ʽ�ζ����У���Ϊ______________��
��2��ʵ�����۾�ע��_____________________��ֱ���ζ��յ㣮�жϵ����յ��������_________��
��3��ʵ���У����в�����������������ȷ��������������Ũ����ʲôӰ�죿����ƫ��ƫС����Ӱ�죩
A. �ζ�ǰ���ӿ̶ȣ��ζ����ӿ̶�_________��
B. ��ƿ��ʢ�Ŵ���Һǰδ�������������ˮ_________��
C. �ζ�������ҡ����ƿ��������ƿ�ڵ���Һ����һ����_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ����ʵ��ʱ������þʧ�����������������̼��������ѻ�����ȴ��ʵ����ʦ��ʱ��ֹ��ԭ����CO2����֧��þȼ�գ�����2Mg��CO2![]() 2MgO��C�����й��ڸ÷�Ӧ���ж���ȷ����(����)
2MgO��C�����й��ڸ÷�Ӧ���ж���ȷ����(����)
A. MgԪ�ػ��ϼ���0�����ߵ���2�ۣ�����MgO�ǻ�ԭ����
B. �ɴ˷�Ӧ�����ж������ԣ�CO2>MgO����ԭ�ԣ�Mg>C
C. CO2�������������������ԣ�����������Ӧ
D. Mgԭ��ʧȥ�ĵ�����Ŀ������ԭ�ӵõ��ĵ�����Ŀ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ȫ����Ű���������ֳ�Ϊ���Լ����������й����ڵ�һЩ���Һ͵����������������Ⱦ�����в��������IJ�������ר�ҷ������ò�������70��-75���Ļ�ѧ�ɷ�Ϊ�����ʣ����Ҫ���Ӹ���ɱ������56��ʱ����30���ӣ�60��ʱ����10���ӣ�70�����ȼ����ӣ�����ֱ��40-48Сʱ����ɱ�������в�����ר�ҵ����������������˵����������е�
A. ���� B. ���� C. ˮ�� D. ��ɫ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ŀǰ���з�չǰ����һ���Բ;��ǣ� ��
A.�����;�
B.���۲;�
C.���ϲ;�
D.ֽľ�;�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com