
����Ŀ������������H2C2O4��ʾ��Ϊ�˲ⶨij������Һ��Ũ�ȣ���������ʵ�飺��ȡWg���ᾧ�壬���100.00mLˮ��Һ��ȡ25.00mL�����ƵIJ�����Һ������ƿ�ڣ���������ϡH2SO4����Ũ��ΪamolL��1��KMnO4��Һ�ζ���KMnO4������ɫΪֹ���������ķ�ӦΪ��2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2��+2MnSO4+8H2O��
�Իش�
��1��ʵ���У���ҺKMnO4��ҺӦװ��_____ʽ�ζ����У���Ϊ______________��
��2��ʵ�����۾�ע��_____________________��ֱ���ζ��յ㣮�жϵ����յ��������_________��
��3��ʵ���У����в�����������������ȷ��������������Ũ����ʲôӰ�죿����ƫ��ƫС����Ӱ�죩
A. �ζ�ǰ���ӿ̶ȣ��ζ����ӿ̶�_________��
B. ��ƿ��ʢ�Ŵ���Һǰδ�������������ˮ_________��
C. �ζ�������ҡ����ƿ��������ƿ�ڵ���Һ����һ����_________��
���𰸡� �� ������ؾ���ǿ������ ��ƿ����ɫ�仯 ��ƿ����Һ��ɫǡ������ɫ��Ϊ�Ϻ�ɫ���Ұ��������ɫ���ָ� ƫС ��Ӱ�� ƫС
�����������⿼��������ԭ��Ӧ�ζ�������������������1�����������Һ��ǿ�����ԣ�Ӧʢװ����ʽ�ζ����У���2���ζ�ʱ�����ֿ��ƻ���������ҡ����ƿ���۾���ƿ����ɫ�仯���ж��յ㣺�����һ�μ���ʱ����ƿ����Һ��ɫǡ������ɫ��Ϊ�Ϻ�ɫ���Ұ��������ɫ���ָ�����3������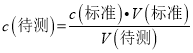 ������֪��A.�ζ�ǰ���ӿ̶ȣ��ζ����ӿ̶ȵ���V(��)��С����c(����)ƫС��B. ��ƿ��ʢ�Ŵ���Һǰδ�������������ˮ����c(����)��Ӱ�죻C. �ζ�������ҡ����ƿ��������ƿ�ڵ���Һ����һ���֣�����n(H2C2O4)��С����ζ�����n(KMnO4)��С����V(��)��С����c(����)ƫС��
������֪��A.�ζ�ǰ���ӿ̶ȣ��ζ����ӿ̶ȵ���V(��)��С����c(����)ƫС��B. ��ƿ��ʢ�Ŵ���Һǰδ�������������ˮ����c(����)��Ӱ�죻C. �ζ�������ҡ����ƿ��������ƿ�ڵ���Һ����һ���֣�����n(H2C2O4)��С����ζ�����n(KMnO4)��С����V(��)��С����c(����)ƫС��


 ���ٴ�����ɽ����ϵ�д�
���ٴ�����ɽ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������Է�������884����һ�ֵ��͵�֬���������ڴ�лʱ�ɷ������·�Ӧ��C57H104O6(s)+80O2(g)��57CO2(g)+52H2O(l)����֪Ҫ����1kg�û�������������Լ200���ÿ����1���ﰴƽ������190 kJ�ƣ����������������ȼ������HԼΪ�� ��
A. 3.8��104kJ��mol-1 B. ��3.8��104kJ��mol-1
C. 3.4��104kJ��mol-1 D. ��3.4��104kJ��mol-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ע��һ����������Ϊ30%��������Һ��������ڣ�Ȼ���������������Ϊ5%��������Һ�У�ÿ��10 min��һ������������������ȷ��ʾ�ⶨ���������ͼ�е�
A.  B.
B. 
C.  D.
D. 
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼʾ����3��Բ�����ɵ�����ϵͼ������IΪ��Բ��II��III�ֱ�Ϊ��Բ֮�ڵ�СԲ������ѡ���з�����������ϵ����( )

A. I: DNA II: RNA III:����
B. I����ԭ���� II������ III������
C. I���̴� II�����̴� III��ά����D
D. I�������� II��ø III������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ں˴Ź����ͼ����ֻ�����ַ��������
A. (CH3)2CHCH2CH2CH3 B. (CH3)2CHCH3
C. (CH3)2CHCH(CH3)2 D. (CH3)3CCH2CH3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ԭ��ӦKClO3 + 6HCl = KCl + 3Cl2��+ 3H2O�У�������0.5 mol Cl2ʱ����������ͻ�ԭ��������ʵ���֮��Ϊ( )
A.5��1B.3��1C.1��3D.1��5
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ģ���ͼ��ʾ��һ�ܱ���������Ħ�����ɻ�����������a��b�ֳɼס������ң���״���£��������г���NH3 0.4 mol�������г���HCl��N2�Ļ�����壬��ֹʱ����λ����ͼ��ʾ����֪�ס��������������������Ϊ17.3g��
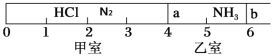
��1�����������������Ϊ________��
��2��������HCl��N2�����ʵ���֮��Ϊ______��
��3��������aȥ������HCl��NH3��ַ�Ӧ����NH4Cl���壨��Ӧ����ʽΪ��HCl(g)+NH3(g)=NH4Cl(s)���������˷�Ӧ��������b��λ�ڿ̶���________�����������֣������ǹ������ʲ�����ѹǿ������ʱ��ϵ��ƽ��Ħ������________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���̼��仯��������������������������;����ʵ������ģ�ҵ�������̿�(��Ҫ�ɷ�ΪMnO2��������SiO2��Fe2O3��Al2O3��)�Ʊ������̵�����,�����������:

��֪:Mn2+�н�ǿ�Ļ�ԭ��,�ڿ������ܱ���������,̼�����ڿ����и��¼��ȹ������ΪMn2O3���������������Ksp(����ֵ)���±���
���� | Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 |
Ksp | 10-13 | 10-17 | 10-39 | 10-33 |
(1)�������ǰ�轫���̿�����Ŀ����_____________���������MnO2������Ӧ�����ӷ���ʽΪ_________________��
(2)����ҺI�����ȼ�A����,�ټ�B����,����������ʾ�Ϊ�ǽ������������Һ,��AΪ(�����ʵ�����)_________��BΪ(�����ʵ�����)________������II�ijɷ���_______(�����ʵĻ�ѧʽ)��
(3)������������˵���Ũ�ȡ�Һ�̱ȡ�����¶ȵ�,���н�ȡ�������ʱ��ı仯��ͼ��ʾ:

����ȡʱ�䳬��4hʱ,�̽�ȡ�ʷ�����С,��ԭ����______________��
(4)�����ҺI��c(Mn2+)=0.1mo/L,�����B������ҺpH��ΧΪ______��(��֪:��ij������Ũ��С��1��10-5mo/Lʱ,����Ϊ�������ȫ�����������λС��)
(5)�������������м��백ˮ��Ŀ����(�ӻ�ѧƽ���ƶ��ĽǶȽ���)______________��
(6)д����MnCO3Ϊԭ���Ʊ������̵Ĺ��������漰�Ļ�ѧ����ʽ:____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ���������(ע������)�У��ǻ���ʵ�鰲ȫ���ǵ��ǣ� ��
�ټ���ʢ��Һ�����ƿʱ��������Ƭ���ʯ
�ھƾ����ڵľƾ�����С�ھƾ����ݻ�������֮һ
��ʵ��ǰ��Ҫ������ʵ��װ�ý��������Լ��
��ϡ��Ũ����ʱ����Ũ�������ձ��ڱ�����ע��ˮ��
��ʵ���������ϴ��Ľྻ�Թܣ�Ҫ�������Թܼ���
A. �٢ڢۢܢ� B. �٢ڢ� C. �ڢۢ� D. �ڢۢ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com