
【题目】兴趣小组在实验室用制备的氯气与一氧化氮在常温常压下合成亚硝酰氯。
【查阅资料】 亚硝酰氯(NOCl,熔点:-64.5 ℃,沸点:-5.5 ℃) 是一种黄色气体,液体状态呈红褐色,遇水易水解。可用于合成清洁剂、触媒剂及中间体等。对眼睛、皮肤和粘膜有强烈刺激性,具有类似氯气和氮氧化物的毒作用。冰水中加入NaCl可降低温度。
【原料制备】 在实验室分别制备原料气NO和Cl2。
(1)用如下装置制备纯净干燥的气体,请补充下表中各仪器中的试剂。
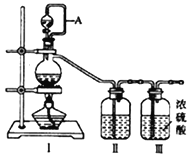
原料制备 | 装置Ⅰ | 装置Ⅰ | 装置Ⅱ |
烧瓶中 | 分液漏斗中 | ||
制备纯净Cl2 | MnO2 | ①__________ | ②______ |
制备纯净NO | Cu | ③_______ | ④_________ |
【合成亚硝酰氯】 利用制得的NO和Cl2制备NOCl,装置如图所示:
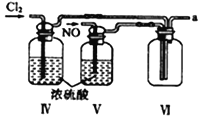
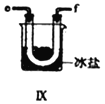
(2)装置Ⅳ、Ⅴ除可进一步干燥NO、Cl2外,另一个作用是___________________。
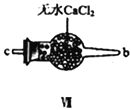
(3)装置连顺序为 a→_______________(按气流自左向右方向,用小写字母表示)。
(4)装置Ⅴ的作用是___________________________________。
(5)装置Ⅸ在实验时,预期观察到的现象是__________________________________________。
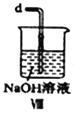
(6)装置Ⅷ中吸收尾气时,NOCl发生反应的化学方程式为________________________。
【拓展学习】
(7)查阅资料,得知配制王水(浓硝酸与浓盐酸的混酸) 时会生成亚硝酰氯和氯气,该反应的化学方程式为__________________________________。
【答案】 浓盐酸 饱和食盐水 稀硝酸 水 通过观察气泡调节气体的流速 e→f→c→b→d(或f→e→c→b→d) 防止水蒸气进入反应器 U型管内充满黄色气体,并有红色液体凝结 NOCl+2NaOH=NaCl+NaNO2+H2O HNO3(浓)+3HCl(浓)=NOCl↑+Cl2↑+2H2O
【解析】(1)实验室用二氧化锰与浓盐酸加热反应制备氯气,分液漏斗中加入浓盐酸;生成的氯气中含有杂质氯化氢、水蒸气;因此混合气体进入装有饱和食盐水的装置Ⅱ中,以除去氯化氢,因此②中加入饱和食盐水;实验室用铜和稀硝酸反应制备一氧化氮,分液漏斗中加入稀硝酸;由于装置内有空气,会有一氧化氮部分氧化为二氧化氮,因此混合气体进入盛有水装置Ⅱ中,除去二氧化氮;正确答案:浓盐酸;饱和食盐水;稀硝酸; 水。
(2)装置Ⅳ、Ⅴ装有浓硫酸,除可进一步干燥NO、Cl2外,另一个作用通过观察气泡的多少来控制气体的速率;正确答案:通过观察气泡调节气体的流速。
(3)氯气和一氧化氮混合后在装置IV中发生反应生成NOCl,通过a进入到IX装置内,进行液化,收集NOCl,多余的尾气再用碱液吸收的同时,必须用VII装置吸收水蒸气,以防止NOCl与水发生水解;所以装置连顺序为a→e→f→c→b→d(或f→e→c→b→d),正确答案:e→f→c→b→d(或f→e→c→b→d)。
(4)装置Ⅴ中装有浓硫酸,起到干燥气体,防止水蒸气进入反应器,正确答案:防止水蒸气进入反应器。
(5)已知:亚硝酰氯(NOCl,熔点:-64.5℃,沸点:-5.5℃)是一种黄色气体,液体状态呈红褐色,遇水易水解;根据信息可知:装置Ⅸ中观察到的现象U型管内充满黄色气体,并有红色液体凝结;正确答案:U型管内充满黄色气体,并有红色液体凝结。
(6)装置Ⅷ中装有碱液,吸收尾气时,氢氧化钠溶液与NOCl发生反应生成氯化钠和亚硝酸钠;化学方程式为:NOCl+2NaOH=NaCl+NaNO2+H2O ;正确答案: NOCl+2NaOH=NaCl+NaNO2+H2O。
(7)浓硝酸与浓盐酸混合时发生氧化还原反应,生成亚硝酰氯和氯气,该反应的化学方程式为HNO3(浓)+3HCl(浓)=NOCl↑+Cl2↑+2H2O;正确答案:HNO3(浓)+3HCl(浓)=NOCl↑+Cl2↑+2H2O。


科目:高中化学 来源: 题型:
【题目】利用铝锂钴废料(主要成分为Co3O4,还含有少量铝箔、LiCoO2等杂质)回收CoO的工艺流程如下:
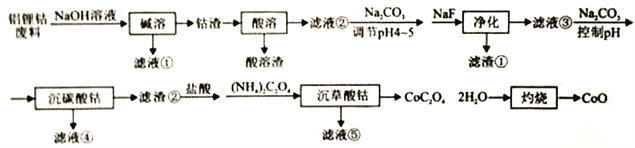
回答下列问题:
(1)“碱溶”的目的是:________________。
(2)不同浸出剂“酸溶”实验结果见下表,根据数据和物质性质应选择的浸出剂是___________(填序号),理由是__________ (用Co3O4参与反应的离子方程式表示)。
浸出剂 | 浸出液化学成分/(g·L-1) | 钴浸出率/% | |
Co | Al | ||
(a)HCI | 80.84 | 5.68 | 98.4 |
(b)H2SO4 | 65.0 | 6.22 | 72.3 |
(c)H2SO4+ Na2S2O3 | 84.91 | 5.96 | 98.0 |
(3)“净化”产生的滤渣为____________(填化学式),滤液③中c(F-)=4.0×10-3mol·L-1,则“净化”后残余c(Li+)=___________。LiF与Li2CO3的Ksp分别为1.8×10-3、1.7×10-3。
(4)若滤液④中含Co2+为5.9×10-2g·L-1,“沉碳酸钴"应控制pH不高于___________。Co(OH)2的Ksp为1.0×10-15。
(5)“沉碳酸钴“→“沉草酸钻”的目的是___________。
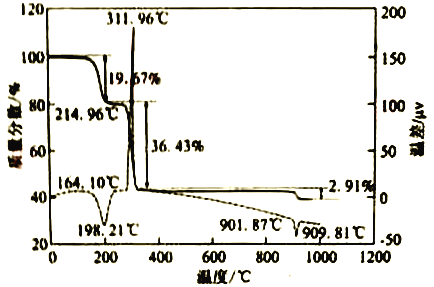
(6)CaC2O4·H2O在空气氛围中的热重曲线如下图。在311.96℃附近有个很强的放热峰的原因是______。900℃发生反应的化学方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某混合溶液中只含有下列几种离子(不考虑水的电离):Na+、Mg2+、Al3+、Cl-、SO42-,若Na+、Mg2+、Cl-、SO42-的物质的量浓度依次为 0.2 mol/L、0.25 mol/L、0.5 mol/L、0.25mol/L,则 c(Al3+)=________ 。
(2) 某物质 A 加热时按化学方程式 2A═2B+C+3D 分解,产物均为气体,测得由生成物组成的混 合物气体对 H2 的相对密度为 20,则反应物 A 的摩尔质量为_____ 。
(3)在标准状况下,将 VL A 气体(摩尔质量为 Mg/mol)溶于 0.1L 水中,所得溶液的密度为ρg/cm3,则此溶液的物质的量浓度为_________mol·L-1
A.1000Vρ/(MV+22400)mol·L-1 B.Vρ/(MV+22400)mol·L-1
C.100VρM/(MV+22400)mol·L-1 D.MV/22.4(V+0.1) ρmol·L-1
(4)生态农业涉及农家肥料的综合利用.某种肥料经发酵得到一种含有甲烷、二氧化碳、氮气 的混合气体 8.96L(标准状况).该气体通过盛有红色 CuO 粉末的硬质玻璃管,发生的反应为:CH4+4CuO![]() CO2↑+2H2O↑+4Cu,.当甲烷完全反应后,硬质玻璃管的质量减轻了 4.8g。将反应后气体通入 2L 0.1mol/L 的澄清 Ca(OH)2 溶液,充分吸收,生成沉淀 10g.求:
CO2↑+2H2O↑+4Cu,.当甲烷完全反应后,硬质玻璃管的质量减轻了 4.8g。将反应后气体通入 2L 0.1mol/L 的澄清 Ca(OH)2 溶液,充分吸收,生成沉淀 10g.求:
①原混合气体中甲烷的体积(标准状况)___________________________________________________
②反应后的气体中 CO2 的物质的量为_______________________
(5)为确定铬钾矾 xK2SO4·yCr2(SO4)3·zH2O的分子式,配成含此物质 31.28g 的溶 液 400mL,取 200mL 的溶液加入 1mol/L 的Ba(NO3)2溶液 100mL,生成沉淀,过滤后滤液中 加入 0.1mol/L H2SO4 溶液,消耗 200mL 硫酸时沉淀恰好完全,用过量氨水处理剩余的 200mL 溶液,生成 Cr(OH)3 沉淀 4.12g,试确定 x、y、z 的值.____________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种重要的化工原料。
(1)氯气是一种黄绿色非金属气体,化学性质上和氧气有许多相似之处,比如:氯气也能支持燃烧,写出铁丝在氯气中燃烧的方程式:______;
(2)氯气和石灰乳反应可以制得漂白粉,漂白粉暴露在空气中因吸收了空气中的CO2和H2O而失效,漂白粉失效过程的化学反应方程式为:______。
(3)氯水中含有多种成分,因而具有多种性质,根据新制氯水分别与如图四种物质发生的反应,填空(b、c、d、e中重合部分代表物质间反应,且氯水足量)。

①c过程的反应方程式______,e过程中的化学方程式为______。
②d过程所观察到的现象为:______,b过程证明了氯水的存在______微粒。
a.Cl2 b.Cl- c.HClO d.H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常认为残留在溶液中的离子浓度小于1×10-5mol/L时,离子不存在。图为H3PO4(图中用H3A表示)在加入强酸或强碱溶液后,平衡时溶液中各微粒浓度的对数值(lgc)-pH图。下列说法不正确的是( )
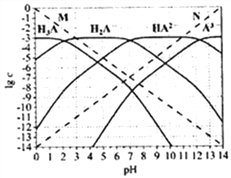
A. H3PO4、H2PO4-、HPO42-、PO43-不能在同一溶液中大量共存
B. H3PO4电离平衡常数Ka2≈1×10-7
C. 图中虚线M、N分别代表H+和OH-
D. pH=10时,溶液中存在关系:c(HPO42-)>c(OH-)>c(PO43-)>c(H2PO4-)>c(H3PO4)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某银白色金属单质A在空气中加热燃烧时发出黄色火焰,得到淡黄色固体B,A暴露在空气中足够长时间变为C,B和酸性气体D能生成C,A和B都能与水生成E,E和D也能生成C。回答下列问题。
(1)写出下列物质的化学式:C_____________,D_____________,E_____________。
(2)写出下列反应的化学方程式:
①A和水生成E:______________________________________________________;
②B和D生成C:______________________________________________________;
③A在空气中加热:___________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应中,属于氧化还原反应的是
A. CaCO3 + 2HCl = CaCl2 + H2O + CO2↑ B. KCl+AgNO3=AgCl↓+KNO3
C. 4NH3+5O2![]() 4NO+6H2O D. CaCO3
4NO+6H2O D. CaCO3 ![]() CaO+CO2↑
CaO+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在浓度均为4.0 mol·L-1的盐酸和硫酸各100 mL溶液中,分别加入等质量的锌粉,充分反应后生成气体体积比为2∶3,则加入锌粉的质量是
A. 6.5 g B. 13.0 g C. 19.5 g D. 26.0 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质所配成的0.1 mol/L溶液中,离子浓度由大到小顺序排列正确的( )
A. NH4Cl:c(Cl-)>c(H+)>c(NH4+)>c(OH-)
B. Na2CO3:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+)
C. NaHCO3:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+)
D. ( NH4)2SO4:c(NH4+)>c(SO42-)>c(H+)>c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com