
【题目】氯气是一种重要的化工原料。
(1)氯气是一种黄绿色非金属气体,化学性质上和氧气有许多相似之处,比如:氯气也能支持燃烧,写出铁丝在氯气中燃烧的方程式:______;
(2)氯气和石灰乳反应可以制得漂白粉,漂白粉暴露在空气中因吸收了空气中的CO2和H2O而失效,漂白粉失效过程的化学反应方程式为:______。
(3)氯水中含有多种成分,因而具有多种性质,根据新制氯水分别与如图四种物质发生的反应,填空(b、c、d、e中重合部分代表物质间反应,且氯水足量)。

①c过程的反应方程式______,e过程中的化学方程式为______。
②d过程所观察到的现象为:______,b过程证明了氯水的存在______微粒。
a.Cl2 b.Cl- c.HClO d.H+
【答案】2Fe+3Cl2![]() 2FeCl3 Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO,2HClO
2FeCl3 Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO,2HClO![]() 2HCl+O2↑ AgNO3+HCl=AgCl↓+HNO3 Cl2+2NaOH=NaCl+NaClO+H2O 溶液先变红而后褪色 d
2HCl+O2↑ AgNO3+HCl=AgCl↓+HNO3 Cl2+2NaOH=NaCl+NaClO+H2O 溶液先变红而后褪色 d
【解析】
(1)铁在氯气中燃烧生成氯化铁,形成红褐色的烟,反应的化学方程式为:2Fe+3Cl2![]() 2FeCl3,故答案为:2Fe+3Cl2
2FeCl3,故答案为:2Fe+3Cl2![]() 2FeCl3;
2FeCl3;
(2)漂白粉暴露在空气中因吸收了空气中的CO2和H2O而失效,是和二氧化碳、水反应生成碳酸钙和次氯酸,次氯酸见光分解得到氯化氢和氧气,反应的化学方程式为:Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO,2HClO![]() 2HCl+O2↑;故答案为:Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO,2HClO
2HCl+O2↑;故答案为:Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO,2HClO![]() 2HCl+O2↑;
2HCl+O2↑;
(3)①c过程的反应是氯水中的盐酸和硝酸银反应得到氯化银沉淀,反应的化学方程式为:AgNO3+HCl=AgCl↓+HNO3,e过程中的化学反应是氯水中的氯气和氢氧化钠发生反应生成氯化钠、次氯酸钠和水,反应的化学方程式为:Cl2+2NaOH=NaCl+NaClO+H2O;故答案为:AgNO3+HCl=AgCl↓+HNO3、Cl2+2NaOH=NaCl+NaClO+H2O;
②氯水中含有盐酸和次氯酸,盐酸具有酸性,次氯酸具有漂白性,d过程所观察到的现象是先变红色,后褪色;b过程是氯水中的盐酸和碳酸钠反应生成二氧化碳气体,证明了氯水中存在酸,存在的微粒为H+,故选d,故答案为:溶液先变红而后褪色、d。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】用 NA 表示阿伏加德罗常数的值,下列说法错误的是( )
A. 标准状况下,22.4L 由 N2 和 N2O 组成的混合气体中,所含有的氦原子的物质的量为 2mol
B. 1.7g NH3 含有的质子数为 NA
C. 标准状况下,11.2L 氦气和氢气的混合气含有的分子数为 0.5NA
D. 1L 0.1mol/LCH3CH2OH 水溶液中含 H 原子数目为 0.6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四碘化锡(SnI4)是一种橙红色固体,熔点为144.5℃,沸点为364℃,易水解,易溶于有机溶剂,实验室通过如图所示装置用锡和碘单质制备SnI4,实验步骤如下:
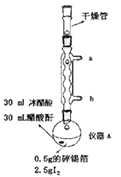
一、洗涤并干燥仪器,然后按照图中标注用量向仪器A中加入各种药品并组装仪器。
二、通入冷凝水,加热仪器A至装置中紫色蒸气消失,溶液颜色由紫红色变为橙红色。
三、停止加热,趁热过滤除去固体杂质,将滤液在烧杯中冷却析出晶体。
四、对所得晶体进行重结晶,过滤、洗涤、干燥、称量。
请回答下列相关问题:
(1)仪器A的名称是__________________,装置中球形冷凝管的作用是__________________,其效果优于直形冷凝管的原因是__________________。
(2)从实验步骤及装置图分析,实验过程中主要目的是防止SnI4水解的操作有___________、_______。
(3)若最终所得晶体的质量为2.2g,则锡的转化率为_______________(保留三位有效数字)。
(4)SnI4遇水发生复分解反应生成一种白色沉淀和一种强酸,检验反应后所得的溶液中的阴离子的常用方法有以下三种,请补充其中所缺试剂。
①沉淀法:稀硝酸和________________;②置换--萃取法;新制氯水和__________________;③利用该元素对应单质的某种特征反应:新制氯水和____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解装置如图所示,电解槽内装有 KI 及淀粉溶液,中间用阴离子交换膜 隔开.在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变 浅。已知:3I2+6OH﹣=IO3﹣+5I﹣+3H2O,下列说法不正确的是( )
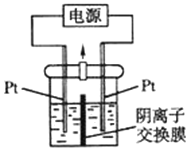
A. 右侧发生的电极反应式:2H2O+2e﹣=H2↑+2OH﹣
B. 电解结束后,右侧溶液中含有 IO3﹣
C. 电解槽内发生反应的总化学方程式:KI+3H2O![]() KIO3+3H2↑
KIO3+3H2↑
D. 如果用阳离子交换膜代替阴离子交换膜,电解槽内发生的总化学方程式不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】兴趣小组在实验室用制备的氯气与一氧化氮在常温常压下合成亚硝酰氯。
【查阅资料】 亚硝酰氯(NOCl,熔点:-64.5 ℃,沸点:-5.5 ℃) 是一种黄色气体,液体状态呈红褐色,遇水易水解。可用于合成清洁剂、触媒剂及中间体等。对眼睛、皮肤和粘膜有强烈刺激性,具有类似氯气和氮氧化物的毒作用。冰水中加入NaCl可降低温度。
【原料制备】 在实验室分别制备原料气NO和Cl2。
(1)用如下装置制备纯净干燥的气体,请补充下表中各仪器中的试剂。
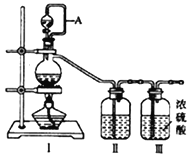
原料制备 | 装置Ⅰ | 装置Ⅰ | 装置Ⅱ |
烧瓶中 | 分液漏斗中 | ||
制备纯净Cl2 | MnO2 | ①__________ | ②______ |
制备纯净NO | Cu | ③_______ | ④_________ |
【合成亚硝酰氯】 利用制得的NO和Cl2制备NOCl,装置如图所示:
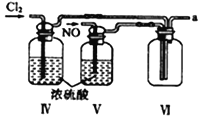
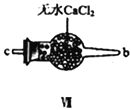
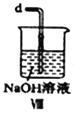
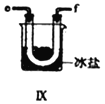
(2)装置Ⅳ、Ⅴ除可进一步干燥NO、Cl2外,另一个作用是___________________。
(3)装置连顺序为 a→_______________(按气流自左向右方向,用小写字母表示)。
(4)装置Ⅴ的作用是___________________________________。
(5)装置Ⅸ在实验时,预期观察到的现象是__________________________________________。
(6)装置Ⅷ中吸收尾气时,NOCl发生反应的化学方程式为________________________。
【拓展学习】
(7)查阅资料,得知配制王水(浓硝酸与浓盐酸的混酸) 时会生成亚硝酰氯和氯气,该反应的化学方程式为__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子检验的方法正确的是
A. 某溶液![]() 有白色沉淀,说明原溶液中有Cl-
有白色沉淀,说明原溶液中有Cl-
B. 某溶液![]() 有蓝色沉淀,说明原溶液中有Cu2+
有蓝色沉淀,说明原溶液中有Cu2+
C. 某溶液![]() 有白色沉淀,说明原溶液中有SO42-
有白色沉淀,说明原溶液中有SO42-
D. 某溶液![]() 生成无色气体,说明原溶液中有CO32-
生成无色气体,说明原溶液中有CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某酸的酸式盐NaHY在水溶液中,HY-的电离程度小于HY-的水解程度。有关的叙述中,正确的是
A. H2Y电离方程式为:H2Y+H2O![]() HY-+H3O+
HY-+H3O+
B. 常温下,该酸式盐的水溶液中溶液中,各离子浓度大小关系为:c(Na+)>c(Y2-)>c(HY-)>c(OH-)>c(H+)
C. 常温下,酸式盐NaHY 的水溶液呈酸性
D. HY-的水解方程式为:HY-+ H2O![]() H3O++Y2-
H3O++Y2-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com