
 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:
| 操作 | 现象 | 结论 | |
| 步骤一 | 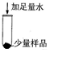 |
固体部分溶解 固体部分溶解 |
猜想二成立 |
| 步骤二 | 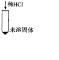 |
固体溶解,产生气泡 固体溶解,产生气泡 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| △ |
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
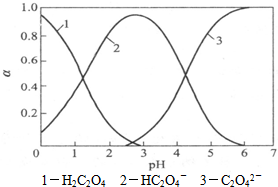 草酸(H2C2O4)是一种二元弱酸,受热能分解,它在水溶液中存在形式的分布与pH关系如图所示:
草酸(H2C2O4)是一种二元弱酸,受热能分解,它在水溶液中存在形式的分布与pH关系如图所示:
| ||
| ||
| 酸 | 铁锈[Fe(OH)3]溶解量/g | 水垢(CaCO3)溶解量/g |
| 盐酸 | 0.7911 | 全溶 |
| 磷酸 | 0.1586 | 微溶 |
| 草酸 | 0.7399 | 0.0036 |
| 醋酸 | 0.1788 | 0.1655 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年北京市通州区高三年级上学期期末摸底考试化学试卷(解析版) 题型:选择题
有关CaCO3的溶解平衡的说法中,不正确的是
A.CaCO3沉淀析出和沉淀溶解不断进行,但速率相等
B.CaCO3难溶于水,其饱和溶液几乎不导电,属于弱电解质溶液
C.升高温度,CaCO3沉淀的溶解度增大
D.向CaCO3沉淀中加入纯碱固体,CaCO3的溶解量降低
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com