
| A、3 | B、4 | C、5 | D、6 |
| 208×49.9% |
| 16 |


 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源: 题型:
 (2008?淮南一模)实验测得A、B、C三种有机物的相对分子质量均为72.
(2008?淮南一模)实验测得A、B、C三种有机物的相对分子质量均为72. +nCH3OH
+nCH3OH| 催化剂 |
| 加热 |
 +nH2O
+nH2O +nCH3OH
+nCH3OH| 催化剂 |
| 加热 |
 +nH2O
+nH2O查看答案和解析>>
科目:高中化学 来源: 题型:
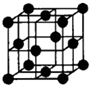
查看答案和解析>>
科目:高中化学 来源:2011-2012学年福建省上杭一中高二下学期期末考试化学试卷(带解析) 题型:填空题
(16分。每空格2分)已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的原子序数依次增大。其中A、C原子的L层有2个未成对电子。D与E同主族,D的二价阳离子与C的阴离子具有相同的电子层结构。F3+离子M层3d轨道电子为半满状态。请根据以上情况,回答下列问题:(答题时,用所对应的元素符号表示)
(1)写出A、B、C三种元素电负性由大到小的顺序 。
(2)由A、B、C和氢四种元素组成的某种离子晶体,1mol该晶体含有配位键2mol,该晶体的化学式是 。
(3)F和Mn(锰)两元素的部分电离能数据列于下表:预测a b(填“大于”、“小于”、“等于”)
理由是
| 元素 | Mn | F | |
| 电离能 ( 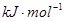 ) ) | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | a | b | |
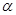 键和
键和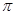 键数目比为 ;
键数目比为 ;| | 熔点/K | 沸点/K | 标准状况时在水中的溶解度 |
| H2S | 187 | 202 | 2.6 |
| H2C2 | 272 | 423 | 以任意比互溶 |
查看答案和解析>>
科目:高中化学 来源:2011-2012学年山东省微山一中高二上学期期中考试化学试卷 题型:填空题
(10分)某烃类化合物A的质谱图表明其相对分子质量为84,红外光谱表明分子中含有碳碳双键,核磁共振氢谱表明分子中只有一种类型的氢。
(1)A的结构简式为______________,名称为___________________________________。
(2)A中的碳原子是否都处于同一平面?________(填“是”或“不是”);A分子是否存在顺反异构体________(填“是”或“否”)。
(3)已知A、B、C有如下转化关系:
|
 ;
;查看答案和解析>>
科目:高中化学 来源:2013届福建省高二下学期期末考试化学试卷(解析版) 题型:填空题
(16分。每空格2分)已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的原子序数依次增大。其中A、C原子的L层有2个未成对电子。D与E同主族,D的二价阳离子与C的阴离子具有相同的电子层结构。F3+离子M层3d轨道电子为半满状态。请根据以上情况,回答下列问题:(答题时,用所对应的元素符号表示)
(1)写出A、B、C三种元素电负性由大到小的顺序 。
(2)由A、B、C和氢四种元素组成的某种离子晶体,1mol该晶体含有配位键2mol,该晶体的化学式是 。
(3)F和Mn(锰)两元素的部分电离能数据列于下表:预测a b(填“大于”、“小于”、“等于”)
理由是
|
元素 |
Mn |
F |
|
|
电离能 ( |
I1 |
717 |
759 |
|
I2 |
1509 |
1561 |
|
|
I3 |
a |
b |
(4)AC2分子中 键和
键和 键数目比为
;
键数目比为
;
AC2分子中A原子的杂化方式是 。
(5)H2S和C元素的氢化物(分子式为H2C2)的主要物理性质比较如下:
|
|
熔点/K |
沸点/K |
标准状况时在水中的溶解度 |
|
H2S |
187 |
202 |
2.6 |
|
H2C2 |
272 |
423 |
以任意比互溶 |
H2S和H2C2的相对分子质量基本相同,造成上述物理性质差异的主要原因是:
①熔点、沸点差异的主要原因
②在水中的溶解度差异的主要原因
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com