
【题目】战国所著《周礼》中记载沿海古人“煤饼烧蛎房成灰”(“蛎房”即牡蛎壳),并把这种灰称为“蜃”。蔡伦改进的造纸术,第一步沤浸树皮脱胶的碱液可用“蜃”溶于水制得。“蜃”的主要成分是( )
A. CaO B. NaHCO3 C. NaOH D. Na2CO3
科目:高中化学 来源: 题型:
【题目】把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水中后有1.16g白色沉淀,在所得的悬独液中逐滴加入1mol·L-1HCl溶液,加入HCl溶液的体积V与生成沉淀的质量m的关系如图所示。试回答:
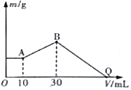
(1)A点沉淀物的化学式为_____________,
(2)AlCl3的物质的量为________________。
(3)HCl溶液在Q点的加入量是_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K3[Fe(C2O4)3]·3H2O(三草酸合铁酸钾)为亮绿色晶体,可用于晒制蓝图。回答下列问题:
(1)晒制蓝图时,用K3[Fe(C2O4)3]·3H2O作感光剂,以K3[Fe(CN)6]溶液为显色剂。其光解反应的化学方程式为:2K3[Fe(C2O4)3]![]() 2FeC2O4+3K2C2O4+2CO2↑;显色反应的化学方程式为______________。
2FeC2O4+3K2C2O4+2CO2↑;显色反应的化学方程式为______________。
(2)某小组为探究三草酸合铁酸钾的热分解产物,按下图所示装置进行实验。
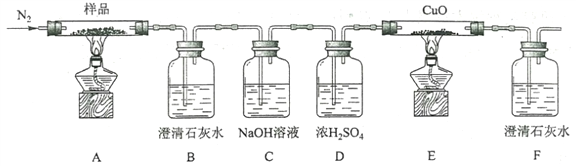
①通入氮气的目的是________________________________________。
②实验中观察到装置B、F中澄清石灰水均变浑浊,装置E中固体变为红色,由此判断热分解产物中一定含有___________、___________。
③为防止倒吸,停止实验时应进行的操作是_____________________________。
④样品完全分解后,装置A中的残留物含有FeO和Fe2O3,检验Fe2O3存在的方法是:________________。
(3)测定三草酸合铁酸钾中铁的含量。
①称量m g样品于锥形瓶中,溶解后加稀H2SO4酸化,用c mol·L-1 KMnO4溶液滴定至终点。滴定终点的现象是___________________________。
②向上述溶液中加入过量锌粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中。加稀H2SO4酸化,用c mol·L-1 KMnO4溶液滴定至终点,消耗KMnO4溶液V mL。该晶体中铁的质量分数的表达式为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知干冰晶胞结构属于面心立方最密堆积,晶胞中最近的相邻两个CO2 分子间距为apm,阿伏加德罗常数为NA,下列说法正确的是
A. 晶胞中一个CO2分子的配位数是8
B. 晶胞的密度表达式是![]() g/cm3
g/cm3
C. 一个晶胞中平均含6个CO2分子
D. CO2分子的空间构型是直线形,中心C原子的杂化类型是sp3杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验是化学研究的基础,下列关于各实验装置的叙述正确的是( )

A. 装置③可用于收集H2、CO2、Cl2、NH3等气体
B. 装置②可用于吸收NH3或HCl气体,并防止倒吸
C. 装置①常用于分离互不相溶的液体混合物
D. 装置④可用于干燥、收集氯化氢,并吸收多余的氯化氢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个不传热的固定容积的密闭容器中,发生可逆反应mA(g)+nB(g)![]() pC(g)+qD(g),当m、n、p、q为任意整数时,不能作为达到平衡标志的是
pC(g)+qD(g),当m、n、p、q为任意整数时,不能作为达到平衡标志的是
A. 体系的压强不再改变B. 体系的温度不再改变
C. 各组分的浓度不再改变D. 各组分的质量分数不再改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯磺酰氰酯(结构简式为 )是一种多用途的有机合成试剂,在HClO4-NaClO4介质中, K5[Co3+O4W12O36](简写为Co3+W)可催化合成氯磺酰氰酯。
)是一种多用途的有机合成试剂,在HClO4-NaClO4介质中, K5[Co3+O4W12O36](简写为Co3+W)可催化合成氯磺酰氰酯。
(1)基态钴原子的核外电子排布式为________________。组成HClO4-NaClO4的4种元素的电负性由小到大的顺序为____________________。
(2)氯磺酰氰酯分子中硫原子和碳原子的杂化轨道类型分别是____________、___________, 1个氯磺酰氰酯分子中含有σ键的数目为______________,氯磺酰氰酯中5种元素的第一电离能由大到小的顺序为_________________。
(3)ClO4-的空间构型为__________________。
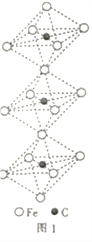
(4)一种由铁、碳形成的间隙化合物的晶体结构如图1所示,其中碳原子位于铁原子形成的八面体的中心,每个铁原子又为两个八面体共用,则该化合物的化学式为________________。
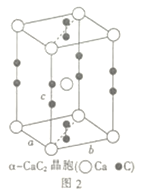
(5)电石(CaC2)是制备氯化氰(ClCN)的重要原料。四方相碳化钙(CaC2)的晶胞结构如上图2所示,其晶胞参数分别为a、b、c,且a=b,c=640pm。已知四方相碳化钙的密度为1.85g·cm-3,[C≡C]2-中键长为120pm,则成键的碳原子与钙原子的距离为________pm和_______pm。(设阿伏加德罗常数的数值为6×1023)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生配制0.1 mol·L-1氢氧化钠溶液 100 mL,下列操作会造成实际浓度偏高的是( )
A.空盘时天平指针指向左边
B.把烧碱放在滤纸上称量
C.定容时俯视刻度线
D.使用部分变质的烧碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向60 mL Na2SO4溶液中加入BaCl2溶液,有关数据见下表:

下列有关说法不正确的是
A. 混合前,BaCl2溶液的物质的量浓度为0.10 mol·L-1
B. 混合前,Na2SO4溶液的物质的量浓度为0.15 mol·L-1
C. 3号实验中沉淀的质量x为1.398 g
D. 完全沉淀60 mL Na2SO4溶液消耗BaCl2溶液的体积为80 mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com