
【题目】对于1LH2SO4和HNO3的混合溶液,若H2SO4和HNO3物质的量浓度存在如下关系:c(H2SO4)+c(HNO3)=1.2mol·L-1,则理论上最多能溶解铜的物质的量为
A. 0.80mol 0.72molB. 0.45molC. 0.40mol
【答案】B
【解析】
金属铜和稀硫酸之间不会反应,但是可以和稀硝酸之间反应,根据反应:3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O来计算。
铜不与硫酸反应,但能提供氢离子,硝酸与铜反应生成硝酸铜,硝酸根离子与硫酸提供的氢离子可以继续反应,反应离子方程式如下:3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O,硝酸根离子的浓度与氢离子的浓度比为1:4时,溶解的铜最多,设硫酸的物质的量为x mol,硝酸的物质的量为ymol,则x+y=1.5,![]() =1:4,解得x=0.9mol,y=0.6mol,设参加反应的铜的最大物质的量是z,
=1:4,解得x=0.9mol,y=0.6mol,设参加反应的铜的最大物质的量是z,
3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O
32
z0.6
![]()
解得:z = 0.9 mol,即理论上最多能溶解铜的物质的量为0.90 mol,C项正确;
答案选C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 用石墨作电极电解食盐水时,若阴极得到2NA个电子,则阳极一定产生22.4 LCl2(已折换算成标准状况下的体积)
B. 2 L 0.05 mol·L-1乙醇溶液中含有H原子数目为0.1NA
C. 4.0 g H![]() O与D2O的混合物中所含中子数为2NA
O与D2O的混合物中所含中子数为2NA
D. 常温下,1 mol的NaHCO3固体中HCO![]() 的个数必定小于NA
的个数必定小于NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X+的核外电子数分别为2、8、8,则X元素在周期表中的位置是( )
A. 第三周期第0族 B. 第四周期第ⅠA族
C. 第三周期第ⅠA族 D. 第三周期第ⅦA族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下、一定体积条件下,能说明下列反应达到平衡状态的是
A.反应2SO2(g)+O2(g)![]() 2SO3(g) 容器内的密度不随时间变化
2SO3(g) 容器内的密度不随时间变化
B.反应A2(g)+B2(g)![]() 2AB(g)容器内A2的消耗速率与AB消耗速率相等
2AB(g)容器内A2的消耗速率与AB消耗速率相等
C.反应N2+3H2![]() 2NH3容器内气体平均相对分子质量不随时间变化
2NH3容器内气体平均相对分子质量不随时间变化
D.反应4A(s)+3B(g)![]() 2C(g)+D(g)容器内气体总压强不随时间变化
2C(g)+D(g)容器内气体总压强不随时间变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙二酸,又称草酸,通常在空气中易被氧化而变质。其两分子结晶水(H2C2O4·2H2O)却能在空气中稳定存在。在分析化学中常用H2C2O4·2H2O做KMnO4的滴定剂,下列关于H2C2O4的说法正确的是
A.草酸是二元弱酸,其电离方程式为H2C2O4![]() 2H++C2O
2H++C2O![]()
B.草酸滴定KMnO4属于中和滴定,可用石蕊做指示剂
C.乙二酸可通过乙烯经过加成、水解、氧化再氧化制得
D.将浓H2SO4滴加到乙二酸上使之脱水分解,分解产物是CO2和H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纯铜在工业上主要用来制造导线、电器元件等,铜能形成+1价和+2价的化合物。
(1)写出基态Cu+的核外电子排布式___________________________________。
(2)如图是铜的某种氧化物的晶胞示意图,该氧化物的化学式为________。

(3)向硫酸铜溶液中滴加氨水会生成蓝色沉淀,再滴加氨水到沉淀刚好全部溶解可得到深蓝色溶液,继续向其中加入极性较小的乙醇可以生成深蓝色的[Cu(NH3)4]SO4·H2O沉淀,该物质中的NH3通过________键与中心离子Cu2+结合,NH3分子中N原子的杂化方式是____。与NH3分子互为等电子体的一种微粒是________。
(4)CuO的熔点比CuCl的熔点____(填“高”或“低”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是甲烷(CH4)和白磷(P4)分子的空间结构示意图,请把你认为是化学键的虚线改为实线,把碳原子涂成实心小圆点(在图上改即可__________)。甲烷分子是________(填“左”、“右”)图。从图中看出,每个甲烷分子中有________对共用电子,而白磷分子中形成______个共价键,键角为________。甲烷是由________键(填“极性”或“非极性”,下同)形成的________分子,白磷是由________键形成的________分子。
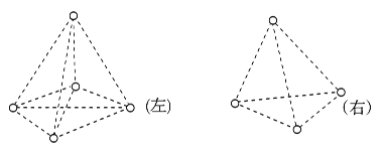
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图所示的N2(g)和O2(g)反应生成NO(g)过程中的能量变化情况,判断下列说法正确的是
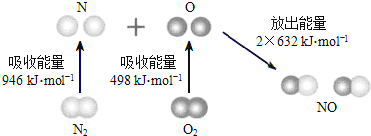
A.N2(g)与O2(g)反应生成NO(g)是放热反应
B.2molO原子结合生成O2(g)时需要放出498kJ能量
C.1molNO(g)分子中的化学键断裂时需要放出632kJ能量
D.N2(g)+O2(g)=2NO(g)△H=+1444kJ/mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验:
实验一 焦亚硫酸钠的制取
采用如图装置(实验前已除尽装置内的空气)制取Na2S2O5。装置Ⅱ中有Na2S2O5晶体析出,发生的反应为:Na2SO3+SO2=Na2S2O5

(1)装置I中产生气体的化学方程式为__________________。
(2)要从装置Ⅱ中获得已析出的晶体,可采取的分离方法是_________。
(3)装置Ⅲ用于处理尾气,可选用的最合理装置(夹持仪器已略去)为________(填序号)。

实验二 焦亚硫酸钠的性质
Na2S2O5溶于水即生成NaHSO3。
(4)证明NaHSO3溶液中HSO3-的电离程度大于水解程度,可采用的实验方法是________(填序号)。
a.测定溶液的pH b.加入Ba(OH)2溶液 c.加入盐酸
d.加入品红溶液 e.用蓝色石蕊试纸检测
(5)检验Na2S2O5晶体在空气中已被氧化的实验方案是____________。
实验三 葡萄酒中抗氧化剂残留量的测定
(6)葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:

(已知:滴定时反应的化学方程式为SO2+I2+2H2O=H2SO4+2HI)
①按上述方案实验,消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为________________g·L-1。
②在上述实验过程中,若有部分HI被空气氧化,则测得结果____(填“偏高”“偏低”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com