
【题目】某化学研究小组探究外界条件对化学反应mA(g)+nB(g)![]() pC(g)的速率和平衡的影响图象如下,下列判断正确的是( )
pC(g)的速率和平衡的影响图象如下,下列判断正确的是( )
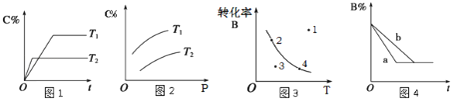
A.由图1可知,T1<T2,该反应正反应为吸热反应
B.由图2可知,该反应m+n<p
C.图3中,表示反应速率v正>v逆的是点3
D.图4中,若m+n=p,则a曲线一定使用了催化剂
【答案】C
【解析】
试题分析:A、由图1可知,温度在T2时首先达到平衡。说明T1<T 2,升高温度,化学反应速率加快,达到平衡所需要的时间缩短;因为在温度为T2时C%减小,说明升高温度,化学平衡向逆反应方向移动,逆反应方向为吸热反应,所以该反应正反应为放热反应,错误;B、由图2可知,在温度不变时,增大压强,C%增多,说明增大压强,化学平衡向正反应方向移动;增大压强,化学平衡向气体体积减小的方向移动,正反应方向为气体体积减小的方向。所以该反应m+n>p,错误;C、图3表示的是在不同的温度下,当反应达到平衡时反应物B的转化率与温度的关系,曲线上的点表示的是平衡状态,v正=v 逆;过3这一点作横坐标的垂下,交曲线与一点。这点的B的转化率高于3这一点,说明3未达到平衡,反应向正反应方向进行,此时表示的反应速率v 正 >v 逆 的是点3,正确;D、图4中,若m+n=p,则a曲线达到平衡所需要的时间比b短,先达到平衡,则可能是使用了催化剂,也可能是增大了压强,缩小了容器的容积,错误。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知乙醛(CH3CHO)和新制氢氧化铜的反应如下:
CH3CHO+2Cu(OH)2+NaOH![]() CH3COONa+Cu2O↓+3H2O
CH3COONa+Cu2O↓+3H2O
某实验小组做上述反应时,发现NaOH的用量对反应产物有影响,于是他们采用控制变量的方法,均使用0.5 mL 40%的乙醛溶液进行下列实验。
编号 | 2%CuSO4溶液的体积 | 10%NaOH溶液的体积 | 振荡后 的现象 | pH | 加乙醛水浴加热后的沉淀颜色 |
1 | 2 mL | 3滴 | 浅蓝绿色沉淀 | 5~6 | 浅蓝绿色沉淀 |
2 | a | 15滴 | 浅蓝色沉淀 | 7~8 | 黑色沉淀 |
3 | 1 mL | 1 mL | 蓝色悬浊沉淀较少 | 9~10 | 红褐色沉淀 |
4 | b | 2 mL | 蓝色悬浊沉淀较多 | 11~12 | 红色沉淀 |
5 | 1 mL | 3 mL | 蓝紫色溶液 | 12~13 | ———— |
(1)上表中a、b应为 (填字母序号)。
A.15滴,1 mL B.2 mL,1 mL C.15滴,2 mL D.2 mL,2 mL
(2)查阅资料可知,实验1中的浅蓝绿色沉淀主要成份为Cu2(OH)2SO4,受热不易分解。写出生成Cu2(OH)2SO4反应的化学方程式 。基于实验1、2的现象可以得出结论:NaOH用量较少时, 。
(3)小组同学推测实验3中的红褐色沉淀可能是CuO和Cu2O的混合物,其理论依据是 。
(4)为了进一步证明实验4中红色沉淀的成分,该小组同学查阅资料得知:Cu2O在碱性条件下稳定,在酸性溶液中可转化为Cu2+、Cu。并进行了以下实验。
ⅰ.将实验4反应后的试管静置,用胶头滴管吸出上层清液。
ⅱ.向下层浊液中加入过量稀硫酸,充分振荡、加热,应观察到的现象是 。
(5)小组同学继续查阅资料得知:Cu(OH)2可与OH-继续反应生成蓝紫色溶液([Cu(OH)4] 2-),由此提出问题:[Cu(OH)4] 2-能否与乙醛发生反应,生成红色沉淀?设计实验解决这一问题,合理的实验步骤是 。基于上述实验,该小组同学获得结论:乙醛参与反应生成红色沉淀时,需控制体系的pH>10。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不能与溴水发生反应的是
①苯②乙烯③亚硫酸④NaOH溶液⑤AgNO3溶液⑥裂化汽油⑦甲烷⑧镁粉
A. ① B. ①⑦ C. ①⑦⑧ D. ①②⑤⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中不含离子键的有几个( )
①NH4HCO3②NH3③BaSO4;④CH3COONa3H2O⑤Ba(OH)2⑥H2SO4 .
A.1个
B.2个
C.3个
D.4个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项所述的数字不是“6”的是
A.在NaCl晶体中,与一个Na+最近的且距离相等的Cl-的个数
B.在金刚石晶体中,最小的环上的碳原子个数
C.在二氧化硅晶体中,最小的环上的原子个数
D.在石墨晶体的片层结构中,最小的环上的碳原子个数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2014年7月18日,淄博疑因某化工厂氯气泄露造成31人中毒。事故发生后采取的措施不正确的是( )
A.群众向高处转移
B.用沾NaOH溶液的湿毛巾捂住口鼻
C.用高压水枪向空中喷洒含碱性物质的水溶液可解毒[
D. 用沾Na2CO3溶液的湿毛巾捂住口鼻
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行如下反应:X2(g)+Y2(g)![]() 2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是
2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是
A. Z为0.3mol/L B. Y2为0.4mol/L
C. X2为0.2mol/L D. Z为0.4mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性溶液X,可能含有Al3+、Ba2+、NH4+ 、Fe2+、Fe3+、CO32-、SO42-、SiO32-、NO3-中的一种或几种离子,取该溶液进行实验,其现象及转化如下图。有一种气体是红棕色。请回答下列问题:
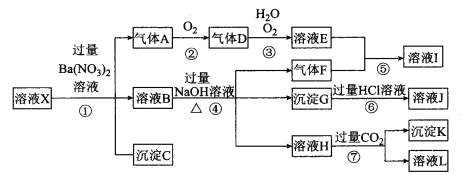
(1)溶液X中除了H+一定存在的离子有________________ 。溶液X中一定不存在的离子有____________ 。
(2)产生气体A的离子方程式为________________________________。
(3)转化⑥发生反应的现象为__________________________________。
(4)转化⑦中的离子方程式为___________________________________。
(5)若转化③中,D、H2O、O2三种物质恰好发生化合反应生成E,则反应中O2与D的物质的量之比为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com