
【题目】月球含有H、He、N、Na、Mg、Si等元素,是人类未来的资源宝库。
(1)3He是高效核能原料,其原子核内中子数为_____________。
(2)Na的原子结构示意图为______,Na在氧气中完全燃烧所得产物的电子式为_______。
(3)MgCl2在工业上应用广泛,可由MgO制备。
①MgO的熔点比BaO的熔点________(填“高”或“低”)
②月球上某矿石经处理得到的MgO中含有少量SiO2,除去SiO2的离子方程式为______;SiO2的晶体类型为________。
③MgO与炭粉和氯气在一定条件下反应可制备MgCl2。若尾气可用足量NaOH溶液完全吸收,则生成的盐为______(写化学式)。
(4)月壤中含有丰富的3He,从月壤中提炼1 kg3He同时可得6000kgH2和700kgN2,若以所得H2和N2为原料经一系列反应最多可制得碳酸氢铵___kg。
【答案】1 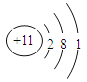
![]() 高 2OH-+SiO2=SiO32-+H2O 原子晶体 NaCl、NaClO、Na2CO3 3950
高 2OH-+SiO2=SiO32-+H2O 原子晶体 NaCl、NaClO、Na2CO3 3950
【解析】
(1)在表示原子组成时元素符号的左下角表示质子数,左上角表示质量数。因为质子数和中子数之和是质量数,因此该核素的原子核内中子数=3-2=1。
(2)原子结构示意图是表示原子核电荷数和电子层排布的图示形式。小圈和圈内的数字表示原子核和核内质子数,弧线表示电子层,弧线上的数字表示该层的电子数。由于钠的原子序数是11,位于元素周期表的第三周期第IA族,因此钠的原子结构示意图为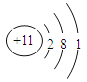 ;钠在氧气中完全燃烧生成过氧化钠,过氧化钠是含有离子键和非极性键的离子化合物,电子式可表示为
;钠在氧气中完全燃烧生成过氧化钠,过氧化钠是含有离子键和非极性键的离子化合物,电子式可表示为![]() 。
。
(3)①氧化镁和氧化钡形成的晶体均是离子晶体,离子晶体的熔点与晶格能有关系。晶格能越大,熔点越高。形成离子键的离子半径越小,离子的电荷数越多离子键越强,晶格能越大。由于镁离子半径小于钡离子半径,因此氧化镁中晶格能大于氧化钡中晶格能,则氧化镁的熔点高于氧化钡的熔点。
②氧化镁是碱性氧化物,二氧化硅是酸性氧化物,能与氢氧化钠溶液反应,而氧化镁与氢氧化钠溶液不反应,因此除去氧化镁中的二氧化硅可以用氢氧化钠溶液,反应的离子方程式为2OH-+SiO2=SiO32-+H2O;二氧化硅是由硅原子和氧原子通过共价键形成的空间网状结构的晶体属于原子晶体。
③氧化镁、炭粉和氯气在一定条件下反应制备氯化镁,另一种生成物可以被氢氧化钠溶液完全吸收,则气体应该是二氧化碳,二氧化碳与足量的氢氧化钠溶液反应生成碳酸钠。另外过量的氯气有毒也需要尾气处理,氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠,则盐的化学式为NaCl、NaClO、Na2CO3。
(4)根据反应的方程式可知
3H2 + N2 = 2NH3
6kg 28kg 34kg
6000kg 28000kg 34000kg
因此氮气不足,则实际生成的氨气的物质的量为![]() ×2,根据氮原子守恒可知,最终生成碳酸氢铵的质量为
×2,根据氮原子守恒可知,最终生成碳酸氢铵的质量为![]() ×2×79g/mol=3950000g=3950kg。
×2×79g/mol=3950000g=3950kg。


科目:高中化学 来源: 题型:
【题目】H2S和SO2会对环境和人体健康带来极大的危害,工业上采取多种方法减少这些有害气体的排放,回答下列各方法中的问题。
Ⅰ.H2S的除去
方法1:生物脱H2S的原理为:
H2S+Fe2(SO4)3![]() S↓+2FeSO4+H2SO4
S↓+2FeSO4+H2SO4
4FeSO4+O2+2H2SO4![]() 2Fe2(SO4)3+2H2O
2Fe2(SO4)3+2H2O
(1)硫杆菌存在时,FeSO4被氧化的速率是无菌时的5×105倍,该菌的作用是______________。
(2)由图3和图4判断使用硫杆菌的最佳条件为______________。若反应温度过高,反应速率下降,其原因是______________。

方法2:在一定条件下,用H2O2氧化H2S
(3)随着参加反应的n(H2O2)/n(H2S)变化,氧化产物不同。当n(H2O2)/n(H2S)=4时,氧化产物的分子式为__________。
Ⅱ.SO2的除去
方法1(双碱法):用NaOH吸收SO2,并用CaO使NaOH再生
NaOH溶液![]() Na2SO3
Na2SO3
(4)写出过程①的离子方程式:____________________________;CaO在水中存在如下转化:
CaO(s)+H2O (l) ![]() Ca(OH)2(s)
Ca(OH)2(s)![]() Ca2+(aq)+2OH(aq)
Ca2+(aq)+2OH(aq)
从平衡移动的角度,简述过程②NaOH再生的原理____________________________________。
方法2:用氨水除去SO2
(5)已知25℃,NH3·H2O的Kb=1.8×105,H2SO3的Ka1=1.3×102,Ka2=6.2×108。若氨水的浓度为2.0 mol·L-1,溶液中的c(OH)=_________________mol·L1。将SO2通入该氨水中,当c(OH)降至1.0×107 mol·L1时,溶液中的c(![]() )/c(
)/c(![]() )=___________________。
)=___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室配制500mL0.1mol/LNa2CO3溶液,回答下列问题
(1)配制Na2CO3溶液时需用的主要仪器有托盘天平、滤纸、烧杯、药匙、___。
(2)容量瓶上标有刻度线、___,使用前要___。
(3)需用托盘天平称取Na2CO3____g。
(4)若实验遇下列情况,溶液的浓度是偏高,偏低还是不变?
A.加水时超过刻度线___,
B.溶解后未冷却到室温就转入容量瓶___,
C.容量瓶内壁附有水珠而未干燥处理___,
D.定容时仰视___,
E.上下颠倒摇匀后液面低于刻线___。
(5)若实验室中要用浓度为16mol/L的浓硫酸配制480mL2.0mol/L的稀硫酸,则需要量取浓硫酸的体积为___mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列各变化中,反应①为常温下的反应,A、C、D均含氯元素,且A中氯元素的化合价介于C与D之间,E常温下为无色无味的液体,F为淡黄色粉末,G为常见的无色气体。
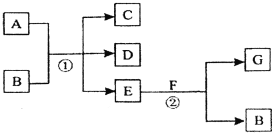
回答下列问题:
(1)A、G的化学式分别为________________、 ________________。
(2)F和E反应的化学方程式为____________________________。
(3)写出反应①的化学方程式____________________________________。
(4)在反应②中,每生成2.24 L气体G(标准状况)时,消耗F ___________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源是人类共同关注的重要问题,甲烷是一种洁净的能源。
(1)甲烷不仅能用作燃料,还可用于生产合成气(CO和H2)。CH4与H2O(g)通入聚焦太阳能反应器,发生反应CH4(g)+H2O(g)=CO(g)+3H2(g)△H1。已知某些化学键的键能数据如下表:
化学键 | C—H | H—H | C≡O | O—H |
键能/kJ·mol-1 | 413 | 436 | 1076 | 463 |
则△H1=___________kJ·mol-1
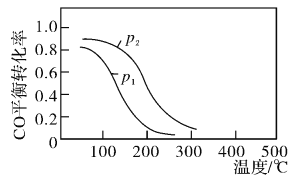
(2)用合成气生成甲醇的反应为:CO(g)+2H2(g)![]() CH3OH(g)△H2,在2L恒容密闭容器中,按物质的量之比1:2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如下图所示,
CH3OH(g)△H2,在2L恒容密闭容器中,按物质的量之比1:2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如下图所示,
200℃时n(H2)随时间的变化如下表所示
t/min | 0 | 1 | 2 | 3 |
n(H2)/mol | 6.0 | 3.4 | 2.0 | 2.0 |
①△H2___________0(填“>”“<”或“=”)
②下列说法正确的是___________(填字母序号)。
a.达平衡后往容器中充入稀有气体,压强增大,平衡向正反应方向移动
b.降低温度,该反应的平衡常数变大
C.容器内气体密度不变,反应达到最大限度
d.图中压强p1>p2
③200℃时,该反应的平衡常数K=___________。
(3)甲烷、氧气和KOH溶液可组成燃料电池。则此燃料电池工作时,通入甲烷的电极为___________极,其电极反应式为______________________,通入氧气的电极反应式为:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温恒容条件下,反应2AB(g)![]() A2(g)+B2(g)达到平衡状态的标志是
A2(g)+B2(g)达到平衡状态的标志是
A. 单位时间内生成n mol A2,同时消耗2n mol AB
B. 容器内,3种气体AB、A2、B2共存
C. 容器中各组分的体积分数不随时间变化
D. AB的消耗速率等于A2的消耗速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KIO3是一种重要的无机化合物,可作为食盐中的补碘剂。回答下列问题:
(1)KIO3的化学名称是_______。
(2)利用“KClO3氧化法”制备KIO3工艺流程如下图所示:

“酸化反应”所得产物有KH(IO3)2、Cl2和KCl。“逐Cl2”采用的方法是________。“滤液”中的溶质主要是_______。“调pH”中发生反应的化学方程式为__________。
(3)KIO3也可采用“电解法”制备,装置如图所示。
①写出电解时阴极的电极反应式______。
②电解过程中通过阳离子交换膜的离子主要为_________,其迁移方向是_____________。
③与“电解法”相比,“KClO3氧化法”的主要不足之处有______________(写出一点)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)常温时CuSO4的水溶液呈____(填“酸”“中”或“碱”)性,原因是(用离子方程式表示_________。
(2)在实验室配制FeCl3溶液时,常将FeCl3固体先溶于较浓的______(填物成名称)中,然后用蒸馏水稀释到所需的浓度,以_________(填“促进”或“抑制”)其水解。
(3)把A1C13溶液蒸干、灼烧,最后得到的主要固体产物是____(写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①-⑨在表中的位置,回答问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(1)表中用于半导体材料的元素在周期表中的位置是__________________。
(2)③、④、⑧的原子半径最小是___________________(用元素符号回答)。
(3)⑤、⑥、⑦的最高价氧化物对应的水化物,碱性最强的是__________(用化学式回答)。
(4)②、③、④的气态氢化物,稳定性最强的是__________(用结构式回答
(5)②和③按原子数1:2形成的化合物的电子式为____________,该晶体气化的过程中克
服的微粒间作用力为_______________________。
(6)③和⑧形成的化合物属于_______________(填“离子化合物”或“共价化合物”),该晶体属于________晶体(填“离子”、“分子”、“原子”)。
(7)元素⑤、⑦的最高价氧化物的水化物互相反应的化学方程式为:___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com