
【题目】在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应)。生成物中含有Cl-、C1O-、C1O3-三种含氯元素的离子,其中C1O-、C1O3-两种离子的物质的量(n)与反应时间(t)的曲线如图所示。
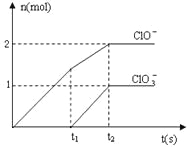
(1)t2时,Ca(OH)2与Cl2发生反应的总化学方程式为:_________________________。
(2)该石灰乳中含有Ca(OH)2的物质的量是______ mol。
(3)据分析,生成Ca(C1O3)2的反应是由温度升高引起的,通入Cl2的速度不同,C1O-和C1O3-的比例也不同。
若在原石灰乳中通入氯气的速度加快,则反应后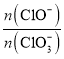 ____2(填“>”、“<”或“=”);
____2(填“>”、“<”或“=”);
若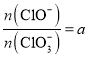 ,则n(C1-)=_________mol(用含a的代数式来表示)。
,则n(C1-)=_________mol(用含a的代数式来表示)。
【答案】10Ca(OH)2+10Cl2=2Ca(C1O)2+Ca(C1O3)2+7CaCl2+10H2O 5 < ![]()
【解析】
(1)在t2时,共生成2molClO-和1molClO3-,即氯气一共失去7mol电子,所以应该也有氯气得到7mol电子变为7molCl-,所以可以写出Ca(OH)2与Cl2发生反应的总化学方程式为10Ca(OH)2+10Cl2=2Ca(C1O)2+Ca(C1O3)2+7CaCl2+10H2O;
(2)由(1)的反应方程式和图像中的数据,我们可以得到该石灰乳中含有Ca(OH)2的物质的量是5mol;
(3)若在原石灰乳中通入氯气的速度加快,则反应温度升高得较快,根据题意则会生成更多的ClO3-,则反应后 <2;若
<2;若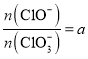 ,即
,即![]() ,假设生成
,假设生成![]() ,则失去了bmol电子,所以生成
,则失去了bmol电子,所以生成![]() ,失去了
,失去了![]() mol电子,故一共失去了
mol电子,故一共失去了![]() mol电子,根据得失电子守恒,反应生成
mol电子,根据得失电子守恒,反应生成![]() mol氯离子,又因为体系中共有5mol钙离子,则n(ClO-)+n(ClO3-)+n(Cl-)=10mol,即b+
mol氯离子,又因为体系中共有5mol钙离子,则n(ClO-)+n(ClO3-)+n(Cl-)=10mol,即b+![]() +
+![]() =10,解得b=
=10,解得b=![]() ,则n(C1-)=
,则n(C1-)= ![]() 。
。


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
【题目】氨基甲酸铵分解反应为NH2COONH4(s)![]() 2NH3(g)+CO2(g),在一体积恒定的容器里,发生上面的反应,可以判断该反应已经达到平衡的是
2NH3(g)+CO2(g),在一体积恒定的容器里,发生上面的反应,可以判断该反应已经达到平衡的是
A. 密闭容器中氨气的体积分数不变
B. 1 mol NH2COONH4分解同时有17g NH3消耗
C. 密闭容器中混合气体的密度不变
D. 混合气体的平均分子量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是( )
A. 温度控制在500℃有利于合成氨反应
B. 用排饱和食盐水法收集Cl2
C. 打开碳酸饮料会有大量气泡冒出
D. 工业制取金属钾Na(l)+KCl(l) ![]() NaCl(l)+K(g)选取适宜的温度,使钾变成蒸气从反应混合物中分离出来
NaCl(l)+K(g)选取适宜的温度,使钾变成蒸气从反应混合物中分离出来
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】混合气体由一种气态烷烃和一种气态烯烃组成,在同温同压下,混合气体对氢气的相对密度为13,在标准状况下,将4.48L混合气体通入足量溴水,溴水质量增重2.8克,通过计算回答:
(1)据题意知混合气体的平均相对分子质量为___,则烷烃分子式为___;
(2)据题意知4.48L混合气体的质量为___克,烷烃的物质的量为___,烯烃的相对分子质量为___;
(3)混合气体中的烯烃分子式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】稀土是一种重要的战略资源。氟碳铈矿主要化学成分为CeFCO3,它是提取铈等稀土元素的重要矿物原料。氟碳铈矿的冶炼工艺流程如下:
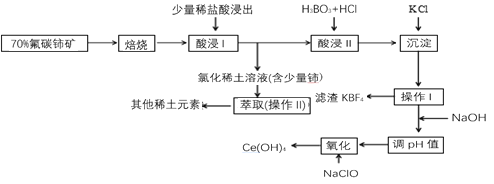
已知:
i.铈的常见化合价为+3、+4。焙烧后铈元素转化成CeO2和CeF4。四价铈不易进入溶液,而三价稀土元素易进入溶液。
ii.酸浸II中发生反应:9CeO2+3CeF4+45HCl+3H3BO3=Ce(BF4)3↓+11CeCl3+6Cl2↑+27H2O
请回答下列问题:
(1)①焙烧氟碳铈矿的目的是_______。
②焙烧后产生的CeO2是汽车尾气净化催化剂的关键成分,它能在还原气氛中供氧,在氧化气氛中耗氧。在尾气消除过程中发生着CeO2![]() CeO2(1-x)+xO2↑的循环。写出CeO2消除CO尾气的化学方程式:________。
CeO2(1-x)+xO2↑的循环。写出CeO2消除CO尾气的化学方程式:________。
(2)在酸浸I中用盐酸浸出时,有少量铈进入滤液,且产生黄绿色气体。少量铈进入稀土溶液发生反应的离子方程式是________。
(3)向Ce(BF4)3中加入KCl溶液的目的是______。
(4)操作I的名称为_______,在实验室中进行操作II时所需要的硅酸盐仪器有_______。
(5)“操作I”后,向溶液中加入NaOH溶液来调节溶液的pH,以获得Ce(OH)3沉淀,常温下加入NaOH调节溶液的pH应大于________即可认为Ce3+已完全沉淀。(已知:Ksp[Ce(OH)3]=1.0×10-20)
(6)取上述流程中得到的Ce(OH)4产品5.000g,加酸溶解后,向其中加入含0.03300mol FeSO4的FeSO4溶液使Ce4+全部被还原成Ce3+,再用0.1000mol·L-1的酸性KMnO4标准溶液滴定至终点时,消耗20.00mL标准溶液。则该产品中Ce(OH)4的质量分数为______(已知氧化性:Ce4+>KMnO4;Ce(OH)4的相对分子质量为208,保留3位有效数字)。
(7)利用电解方法也可以实现铈的回收。在酸性条件下电解Ce2O3(如图),离子交换膜为____(填“阴”或“阳”)离子交换膜。
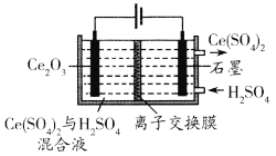
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是部分常见元素的单质及其化合物的转化关系图(有关反应的条件及生成的部分产物已略去)。
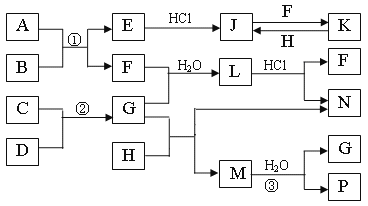
已知:E为红色固体,K为浅绿色溶液;反应②是化工生产中的重要反应;B、C、D、H是单质;B、C、D、F、G、H常温下是气态;F、P和H的水溶液均具有漂白作用,且F是形成酸雨的主要物质之一;N是一种常见的氮肥;化合物G分子构型为三角锥形,化合物M由两种元素组成,分子内共有58个电子。
(1)化合物A中含有的两种元素是___。
(2)F的化学式___;G的水溶液中,最多的阳离子是___。
(3)写出K与H反应的离子方程式:___。
(4)在实验室中,向饱和H水溶液中加入CaCO3粉末,充分反应后过滤,可制得浓度较大的P的水溶液。使用化学平衡移动原理加以解释___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 天然气、水煤气、液化石油气均是生活中常用的燃料,它们的主要成分都是化合物
B. “中国天眼”的“眼眶”是钢铁结成的圈梁,属于金属材料
C. 制玻璃和水泥都要用到石灰石原料
D. 1996年人工合成了第112号元素鎶(Cn),盛放鎶的容器上应该贴的标签是![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述能说明氯元素原子得电子能力比硫元素原子强的是( )
①![]() 的溶解度比
的溶解度比![]() 大 ②
大 ②![]() 的酸性比氢硫酸强 ③
的酸性比氢硫酸强 ③![]() 的稳定性比
的稳定性比![]() 强 ④
强 ④![]() 的还原性比
的还原性比![]() 强 ⑤
强 ⑤![]() 的酸性比
的酸性比![]() 强 ⑥
强 ⑥![]() 与铁反应生成
与铁反应生成![]() ,而
,而![]() 与铁反应生成
与铁反应生成![]() ⑦
⑦![]() 能与
能与![]() 反应生成
反应生成![]() ⑧在元素周期表中
⑧在元素周期表中![]() 处于
处于![]() 同周期的右侧 ⑨还原性:
同周期的右侧 ⑨还原性:![]()
A.③④⑤⑦⑧⑨B.③④⑥⑦⑧
C.③⑥⑦⑧⑨D.①②③④⑤⑥⑦⑧⑨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X元素原于的核电荷数小于18,最外层电子数等于电子层数,且比最内层电子数多1。回答下列问题:
(1)X元素的原子结构示意图为__________。
(2)X的最高价氧化物对应的水化物的化学式为___________。
(3)X的单质与NaOH溶液反应的化学方程式为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com