
【题目】混合气体由一种气态烷烃和一种气态烯烃组成,在同温同压下,混合气体对氢气的相对密度为13,在标准状况下,将4.48L混合气体通入足量溴水,溴水质量增重2.8克,通过计算回答:
(1)据题意知混合气体的平均相对分子质量为___,则烷烃分子式为___;
(2)据题意知4.48L混合气体的质量为___克,烷烃的物质的量为___,烯烃的相对分子质量为___;
(3)混合气体中的烯烃分子式为___。
【答案】26 CH4 5.2 0.15 56 C4H8
【解析】
混合气体由一种气态烷烃和一种气态烯烃组成,在同温同压下,摩尔质量之比等于密度之比,故混合气体对氢气的相对密度为13,即混合气体的摩尔质量为26g/mol;在标准状况下,将4.48L即0.2mol混合气体通入足量溴水,溴水与只与烯烃反应,溴水质量增重2.8克,即0.2mol混合气体中烯烃的质量为2.8g,烷烃的质量为0.2mol×26g/mol-2.8g=2.4g。
(1)据题意知混合气体的平均相对分子质量为26,烯烃中相对分子质量最小的为乙烯,相对分子质量为28,故混合气体中一定含有甲烷,即烷烃分子式为CH4;
(2)据上题可知,4.48L混合气体的质量0.2mol×26g/mol=5.2克,烷烃的物质的量为![]() mol,烯烃的物质的量为0.2mol-0.15mol=0.05mol,烯烃的摩尔质量为
mol,烯烃的物质的量为0.2mol-0.15mol=0.05mol,烯烃的摩尔质量为![]() g/mol,则其相对分子质量为56。
g/mol,则其相对分子质量为56。
(3)根据烯烃结构通式CnH2n可知,烯烃相对分子质量为56,n=4,混合气体中的烯烃分子式为C4H8。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】利用反应:2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)△H=-746.8kJmol-1,可净化汽车尾气,要提高反应的速率和尾气的转化率,采取的措施是( )
2CO2(g)+N2(g)△H=-746.8kJmol-1,可净化汽车尾气,要提高反应的速率和尾气的转化率,采取的措施是( )
A.降低温度
B.增大压强
C.在发生反应的密封容器中充入氦气
D.及时将CO2和N2从反应体系中移走
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KClO3热分解是实验室制取氧气的一种方法,1molKClO3(s)热分解的能量变化如图所示。实验测得第一放热温度为400℃,第二放热温度为480℃。下列说法正确的是( )
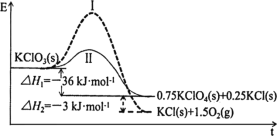
A.400℃时KClO3热分解的产物是KCl和O2
B.若用MnO2作催化剂,KClO3热分解温度大于480℃
C.曲线Ⅰ的活化能大于曲线Ⅱ,所以KClO3比KClO4稳定
D.2KClO3(s)=2KCl(s)+3O2(g) ΔH=-78kJ·mol1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将1 mol A(g)和1 mol B(g)充入2 L密闭容器中发生反应A(g)+B(g)xC(g)+D(s),在t1时达到平衡。在t2、t3时刻分别改变反应的一个条件,测得容器中C(g)的浓度随时间变化如图所示。下列有关说法正确的是

A. 反应方程式中x=2
B. t2时刻改变的条件是使用催化剂
C. t3时刻改变的条件是移去少量D
D. t1~t3间该反应的平衡常数不相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组拟合成西他沙星的中间体X。其流程如下:

已知:①![]() +CH3CH2Br
+CH3CH2Br![]()
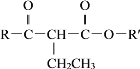
②R-CH2Br+![]()
![]()
![]() +HBr
+HBr
③![]() +H-CH2-COOR″
+H-CH2-COOR″![]() RCOCH2COOR″+R′-OH
RCOCH2COOR″+R′-OH
请回答:
(1)下列说法正确的是___。
A.化合物A不能与H2发生加成反应
B.化合物D→E,发生了取代反应
C.化合物F的水解产物具有两性
D.化合物G分子式为C13H15ON2
(2)化合物C的结构简式___。
(3)写出E→F的化学方程式___。
(4)中间体X有多种同分异构体,写出3种同时满足下列条件的X的同分异构体结构简式___。
①分子中含有一个六元碳环;②含有![]() 结构。
结构。
(5)以乙醇为原料,设计合成A的路线(无机试剂任选,用流程图表示)__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】储氢材料甲由X、Y、Z三种短周期元素组成,Z元素的最外层电子数是X与Y元素最外层电子数之和的1.5倍。为确定甲的组成,进行了如下实验:
①称取5.4g甲固体,加热到250℃时,完全反应后,放出标准状况下3.36 L单质气体乙,同时得到两种固体,其中一种为二元化合物。
②冷却后,向①反应后的固体混合物中加入足量的蒸馏水,充分反应后,又放出标准状况下5.6L单质气体乙,同时得到澄清溶液丙。
请回答:
(1)乙的电子式___。
(2)甲的化学式__。
(3)写出生成溶液丙的化学反应方程式___。
(4)设计实验方案检验溶液丙中的溶质成分___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应)。生成物中含有Cl-、C1O-、C1O3-三种含氯元素的离子,其中C1O-、C1O3-两种离子的物质的量(n)与反应时间(t)的曲线如图所示。
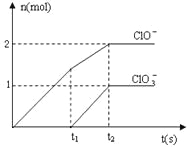
(1)t2时,Ca(OH)2与Cl2发生反应的总化学方程式为:_________________________。
(2)该石灰乳中含有Ca(OH)2的物质的量是______ mol。
(3)据分析,生成Ca(C1O3)2的反应是由温度升高引起的,通入Cl2的速度不同,C1O-和C1O3-的比例也不同。
若在原石灰乳中通入氯气的速度加快,则反应后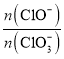 ____2(填“>”、“<”或“=”);
____2(填“>”、“<”或“=”);
若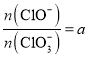 ,则n(C1-)=_________mol(用含a的代数式来表示)。
,则n(C1-)=_________mol(用含a的代数式来表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种位于不同主族的短周期元素X、Y、Z、W的原子序数依次增大,![]() 的内层电子与最外层电子数之比为2:5,Z和W位于同一周期。Z与W组成的化合物是常用的调味品,也是重要的医用药剂,工业上电解该化合物的熔融物可制得Z单质,Y和Z可形成两种离子化合物,这两种离子化合物的阴离子与阳离子数之比均为1:2。下列说法正确的是
的内层电子与最外层电子数之比为2:5,Z和W位于同一周期。Z与W组成的化合物是常用的调味品,也是重要的医用药剂,工业上电解该化合物的熔融物可制得Z单质,Y和Z可形成两种离子化合物,这两种离子化合物的阴离子与阳离子数之比均为1:2。下列说法正确的是
A. 四种元素中至少有两种金属元素
B. 四种元素的常见氢化物中熔点最高的是![]() 的氢化物
的氢化物
C. 四种元素形成的简单高子中,离子半径最小的是元素![]() 形成的离子
形成的离子
D. 常温下,![]() 三种元素形成的化合物的水溶液的
三种元素形成的化合物的水溶液的![]() 小于7
小于7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下在容积为2 L的密闭容器内进行某一反应,容器内气体X、气体Y的物质的量随反应时间变化的曲线如图所示。据图可知( )
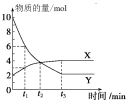
A.反应的化学方程式为4X=Y
B.反应进行到t1时,Y的浓度减少了3 mol/L
C.反应进行到t2时,达到平衡状态
D.反应进行到t3时,每生成4 mol Y的同时生成1 mol X
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com