
【题目】一定温度下在容积为2 L的密闭容器内进行某一反应,容器内气体X、气体Y的物质的量随反应时间变化的曲线如图所示。据图可知( )
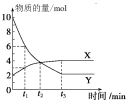
A.反应的化学方程式为4X=Y
B.反应进行到t1时,Y的浓度减少了3 mol/L
C.反应进行到t2时,达到平衡状态
D.反应进行到t3时,每生成4 mol Y的同时生成1 mol X
【答案】D
【解析】
A.据图可知X的物质的量增大,应为生成物,Y的物质的量减小,应为反应物,t3时刻之后X和Y的物质的量不在发生改变,且二者共存,说明该反应为可逆反应,相同时间内△n(X):△n(Y)=1:4,所以该反应的化学方程式为4Y![]() X,故A错误;
X,故A错误;
B.据图可知反应进行到t1时,Y的物质的量减少了(10-6)mol=4mol,容器体积为2L,则Y的浓度减少了2mol/L,故B错误;
C.t2时刻之后Y和X的物质的量还在发生变化,所以此时未达到平衡,故C错误;
D.t3时刻之后X和Y的物质的量不在发生改变,说明此时反应到达平衡,正逆反应速率相等,即每生成4 mol Y的同时生成1 mol X,故D正确;
综上所述答案为D。


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:
【题目】混合气体由一种气态烷烃和一种气态烯烃组成,在同温同压下,混合气体对氢气的相对密度为13,在标准状况下,将4.48L混合气体通入足量溴水,溴水质量增重2.8克,通过计算回答:
(1)据题意知混合气体的平均相对分子质量为___,则烷烃分子式为___;
(2)据题意知4.48L混合气体的质量为___克,烷烃的物质的量为___,烯烃的相对分子质量为___;
(3)混合气体中的烯烃分子式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述能说明氯元素原子得电子能力比硫元素原子强的是( )
①![]() 的溶解度比
的溶解度比![]() 大 ②
大 ②![]() 的酸性比氢硫酸强 ③
的酸性比氢硫酸强 ③![]() 的稳定性比
的稳定性比![]() 强 ④
强 ④![]() 的还原性比
的还原性比![]() 强 ⑤
强 ⑤![]() 的酸性比
的酸性比![]() 强 ⑥
强 ⑥![]() 与铁反应生成
与铁反应生成![]() ,而
,而![]() 与铁反应生成
与铁反应生成![]() ⑦
⑦![]() 能与
能与![]() 反应生成
反应生成![]() ⑧在元素周期表中
⑧在元素周期表中![]() 处于
处于![]() 同周期的右侧 ⑨还原性:
同周期的右侧 ⑨还原性:![]()
A.③④⑤⑦⑧⑨B.③④⑥⑦⑧
C.③⑥⑦⑧⑨D.①②③④⑤⑥⑦⑧⑨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C三种元素的原子中,质于数:A<B<C,且都小于18。A元素原子的最外层电子数是次外层电子数的2倍;B元素原子的M层电子数是L层电子数的一半;C元素原子的次外层电子数比最外层电子数多1。试回答下列问题。
(1)写出三种元素的名称和符号:A______,B______,C______。
(2)画出三种元素的原子结构示意图:A______,B______,C______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】祖母绿是四大名贵宝石之一,主要成分为Be3Al2Si6O18,含有微量的Cr、Ni、Fe元素而呈现各种颜色。回答下列问题:
(1)基态Ni2+的电子排布式为_______________;宝石中Si的杂化方式是____。
(2)成键元素电负性差值越大,化学键离子性百分数越高,在卤素与Al组成的化合物中,离子性百分数最高的化合物是______(填化学式)。
(3)六羰基铬[Cr(CO)6]用于制高纯度铬粉,它的沸点为220℃。Cr(CO)6的晶体类型是______,加热Cr(CO)6可得到高纯度铬粉和CO,反应破坏的作用力类型为_________。
(4)多数配离子显示颜色与d轨道的分裂能有关。分裂能是指配离子的中心原子(离子)的一个电子从较低能量的d轨道跃迁到较高能量的d轨道所需的能量(用Δ表示),它与中心离子的结构、电荷、配体有关。试判断分裂能Δ[Fe(H2O)63+] _____ Δ[Fe(H2O)62+](填“>”“<”或“=”),理由是__________。
(5)氧化镍晶胞如图所示,A的原子坐标参数为:(0,0,![]() ),则底面面心B的原子坐标参数为______。
),则底面面心B的原子坐标参数为______。
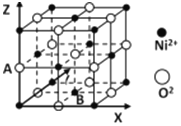
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从废铅蓄电池铅膏(含PbSO4、PbO2和Pb等)中回收铅的一种工艺流程如下:

已知:浓硫酸不与PbO2反应,Ksp(PbCl2)=2.0×10-5,Ksp(PbSO4)=1.5×10-8,PbCl2(s)+2Cl-(aq)=PbCl42-(aq)。下列说法错误的是
A. 合理处理废铅蓄电池有利于资源再利用和防止重金属污染
B. 步骤①中可用浓硫酸代替浓盐酸
C. 步骤①、②、③中均涉及过滤操作
D. PbSO4(s)+2Cl-(aq)![]() PbCl2(s)+SO42-(aq)的平衡常数为7.5×10-4
PbCl2(s)+SO42-(aq)的平衡常数为7.5×10-4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X元素原于的核电荷数小于18,最外层电子数等于电子层数,且比最内层电子数多1。回答下列问题:
(1)X元素的原子结构示意图为__________。
(2)X的最高价氧化物对应的水化物的化学式为___________。
(3)X的单质与NaOH溶液反应的化学方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:①Cl2+2KBr=2KCl+Br2 ②KClO3+6HCl=3Cl2+KCl+3H2O ③ 2KBrO3+Cl2=Br2+2KClO3,下面说法正确的
A.上述三个反应都有单质生成,所以都是置换反应
B.反应②中还原剂与氧化剂的物质的量之比为6:1
C.反应③中1mol Cl2反应,则氧化剂得电子的物质的量为10mol
D.氧化性由强到弱的顺序为:KClO3>KBrO3>Cl2>Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. 饱和Na2CO3溶液与CaSO4固体反应:CO32+CaSO4![]() CaCO3+SO42
CaCO3+SO42
B. 酸化NaIO3和NaI的混合溶液:I +IO3+6H+![]() I2+3H2O
I2+3H2O
C. KClO碱性溶液与Fe(OH)3反应:3ClO+2Fe(OH)3![]() 2FeO42+3Cl+4H++H2O
2FeO42+3Cl+4H++H2O
D. 电解饱和食盐水:2Cl+2H+![]() Cl2↑+ H2↑
Cl2↑+ H2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com