
【题目】祖母绿是四大名贵宝石之一,主要成分为Be3Al2Si6O18,含有微量的Cr、Ni、Fe元素而呈现各种颜色。回答下列问题:
(1)基态Ni2+的电子排布式为_______________;宝石中Si的杂化方式是____。
(2)成键元素电负性差值越大,化学键离子性百分数越高,在卤素与Al组成的化合物中,离子性百分数最高的化合物是______(填化学式)。
(3)六羰基铬[Cr(CO)6]用于制高纯度铬粉,它的沸点为220℃。Cr(CO)6的晶体类型是______,加热Cr(CO)6可得到高纯度铬粉和CO,反应破坏的作用力类型为_________。
(4)多数配离子显示颜色与d轨道的分裂能有关。分裂能是指配离子的中心原子(离子)的一个电子从较低能量的d轨道跃迁到较高能量的d轨道所需的能量(用Δ表示),它与中心离子的结构、电荷、配体有关。试判断分裂能Δ[Fe(H2O)63+] _____ Δ[Fe(H2O)62+](填“>”“<”或“=”),理由是__________。
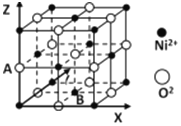
(5)氧化镍晶胞如图所示,A的原子坐标参数为:(0,0,![]() ),则底面面心B的原子坐标参数为______。
),则底面面心B的原子坐标参数为______。
【答案】1s22s22p63s23p63d8(或[Ar]3d8) sp3 AlF3 分子晶体 配位键 > Fe3+的正电荷数比Fe2+的多,吸引电子能力更强;Fe3+的3d达到半充满稳定结构,Fe2+的3d未达到半充满稳定结构 (![]() ,
,![]() ,0)
,0)
【解析】
(1)Ni为28号元素,基态Ni的电子排布式为1s22s22p63s23p63d84s2,则基态Ni2+的电子排布式为1s22s22p63s23p63d8(或[Ar]3d8);宝石中Si与周围原子形成4个共价键,即宝石中Si的价层电子对数为4,则杂化方式是sp3。答案为:1s22s22p63s23p63d8(或[Ar]3d8);sp3;
(2)成键元素电负性差值越大,化学键离子性百分数越高,卤素与Al组成的化合物中,F与Al的电负性差值最大,所以离子性百分数最高的化合物是AlF3。答案为:AlF3;
(3)六羰基铬[Cr(CO)6]的沸点低,则Cr(CO)6的晶体类型是分子晶体,加热Cr(CO)6可得到高纯度铬粉和CO,反应破坏的是Cr与CO之间的配位键,所以作用力类型为配位键。答案为:分子晶体;配位键;
(4)在Fe(H2O)63+和Fe(H2O)62+中,中心原子分别为Fe3+和Fe2+,从带电荷考虑,Fe3+带正电荷高,吸引电子的能力强;从稳定性考虑,它们的价电子排布分别为3d5、3d6,3d5中轨道半充满,电子的能力低,电子跃迁所需的能量高,综合以上分析,分裂能Δ[Fe(H2O)63+]>Δ[Fe(H2O)62+],理由是:Fe3+的正电荷数比Fe2+的多,吸引电子能力更强;Fe3+的3d达到半充满稳定结构,Fe2+的3d未达到半充满稳定结构。答案为:>;Fe3+的正电荷数比Fe2+的多,吸引电子能力更强;Fe3+的3d达到半充满稳定结构,Fe2+的3d未达到半充满稳定结构;
(5)由氧化镍晶胞图中A的原子坐标参数 (0,0,![]() ),可确定坐标轴的0点为左下角的坐标轴交叉点,0~A之间的距离为
),可确定坐标轴的0点为左下角的坐标轴交叉点,0~A之间的距离为![]() ,则底面面心B的原子坐标参数为(
,则底面面心B的原子坐标参数为(![]() ,
,![]() ,0)。答案为:(
,0)。答案为:(![]() ,
,![]() ,0)。
,0)。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某研究小组拟合成西他沙星的中间体X。其流程如下:

已知:①![]() +CH3CH2Br
+CH3CH2Br![]()
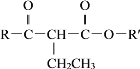
②R-CH2Br+![]()
![]()
![]() +HBr
+HBr
③![]() +H-CH2-COOR″
+H-CH2-COOR″![]() RCOCH2COOR″+R′-OH
RCOCH2COOR″+R′-OH
请回答:
(1)下列说法正确的是___。
A.化合物A不能与H2发生加成反应
B.化合物D→E,发生了取代反应
C.化合物F的水解产物具有两性
D.化合物G分子式为C13H15ON2
(2)化合物C的结构简式___。
(3)写出E→F的化学方程式___。
(4)中间体X有多种同分异构体,写出3种同时满足下列条件的X的同分异构体结构简式___。
①分子中含有一个六元碳环;②含有![]() 结构。
结构。
(5)以乙醇为原料,设计合成A的路线(无机试剂任选,用流程图表示)__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 是原子序数依次增大的短周期主族元素,
是原子序数依次增大的短周期主族元素,![]() 核内只有1个质子,
核内只有1个质子,![]() 原子最外层电子数是次外层电子数的3倍,
原子最外层电子数是次外层电子数的3倍,![]() 的二价阳离子与氖原子具有相同的核外电子排布,
的二价阳离子与氖原子具有相同的核外电子排布,![]() 与
与![]() 同主族,下列说法正确的是( )
同主族,下列说法正确的是( )
A.![]() 的原子半径在五种原子中最大
的原子半径在五种原子中最大
B.一定条件下,![]() 的单质能与水反应
的单质能与水反应
C.![]() 与
与![]() 形成的化合物只有一种
形成的化合物只有一种
D.![]() 的最高价氧化物的水化物的酸性比
的最高价氧化物的水化物的酸性比![]() 的弱
的弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。反应A:4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g)
2Cl2(g)+2H2O(g)
已知:I.反应A中,4molHCl被氧化,放出115.6kJ热量。
II.
判断下列说法正确的是( )
A. 反应A的△H>-115.6kJ·mol-1
B. H2O中H—O键比HCl中H—Cl键弱
C. 由II中的数据判断氯元素的非金属性比氧元素强
D. 断开1molH—O键与断开1molH—Cl键所需能量相差31.9kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F的核电荷数依次增大,且均为核电荷数小于18的非稀有气体元素。A的单质是自然界中密度最小的气体,A和C可形成A2C和A2C2两种常见的液态化合物,B、C原子的最外层电子数之和等于11,D+与C的简单离子的最外层电子排布相同,C、E原子的最外层电子数相同。请回答下列问题:
(1)写出元素符号:B______,D______。
(2)A元素具有两个中子的核素的表示符号为______,E的简单离子的结构示意图是______。
(3) A2C2的分子式为______。
(4)将少量![]() 的单质通入足量NaOH溶液中,发生反应的离子方程式是______。
的单质通入足量NaOH溶液中,发生反应的离子方程式是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下在容积为2 L的密闭容器内进行某一反应,容器内气体X、气体Y的物质的量随反应时间变化的曲线如图所示。据图可知( )
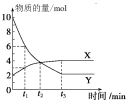
A.反应的化学方程式为4X=Y
B.反应进行到t1时,Y的浓度减少了3 mol/L
C.反应进行到t2时,达到平衡状态
D.反应进行到t3时,每生成4 mol Y的同时生成1 mol X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中错误的是( )
A.形成配位键后,离子的颜色、溶解性和某些化学性质会发生改变
B.配位数为4的配合单元一定呈正四面体结构,配位数为6的配合单元一定呈正八面体结构
C.配位化合物Ni(CO)4结构如图,1mol分子中所含的配位键个数有8NA
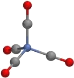
D.[Pt(NH3)6]2+和[PtCl4]2-中,其中心离子的化合价都是+2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W为短周期主族元素,在周期表中的相对位置如图,下列说法正确的是( )

A. 若HmXOn为强酸,则X的氢化物溶于水一定显酸性(m、n均为正整数)
B. 若四种元素均为金属,则Z的最高价氧化物对应的水化物一定为强碱
C. 若四种元素均为非金属,则W的最高价氧化物对应的水化物一定为强酸
D. 若四种元素中只有一种为金属,则Z与Y两者的最高价氧化物对应的水化物能反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值。俗名为“臭碱”的硫化钠广泛应用于冶金染料、皮革、电镀等工业。硫化钠的一种制备方法是Na2SO4+2C![]() Na2S+2CO2↑。下列有关说法正确的是
Na2S+2CO2↑。下列有关说法正确的是
A. 1mol/LNa2SO4溶液中含氧原子的数目一定大于4NA
B. 1L0.1mol/LNa2S溶液中含阴离子的数目小于0.1NA
C. 生成1mol氧化产物时转移电子数为4NA
D. 通常状况下11.2LCO2中含质子的数目为11NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com