
【题目】已知A、B、C三种元素的原子中,质于数:A<B<C,且都小于18。A元素原子的最外层电子数是次外层电子数的2倍;B元素原子的M层电子数是L层电子数的一半;C元素原子的次外层电子数比最外层电子数多1。试回答下列问题。
(1)写出三种元素的名称和符号:A______,B______,C______。
(2)画出三种元素的原子结构示意图:A______,B______,C______。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,将1 mol A(g)和1 mol B(g)充入2 L密闭容器中发生反应A(g)+B(g)xC(g)+D(s),在t1时达到平衡。在t2、t3时刻分别改变反应的一个条件,测得容器中C(g)的浓度随时间变化如图所示。下列有关说法正确的是

A. 反应方程式中x=2
B. t2时刻改变的条件是使用催化剂
C. t3时刻改变的条件是移去少量D
D. t1~t3间该反应的平衡常数不相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种位于不同主族的短周期元素X、Y、Z、W的原子序数依次增大,![]() 的内层电子与最外层电子数之比为2:5,Z和W位于同一周期。Z与W组成的化合物是常用的调味品,也是重要的医用药剂,工业上电解该化合物的熔融物可制得Z单质,Y和Z可形成两种离子化合物,这两种离子化合物的阴离子与阳离子数之比均为1:2。下列说法正确的是
的内层电子与最外层电子数之比为2:5,Z和W位于同一周期。Z与W组成的化合物是常用的调味品,也是重要的医用药剂,工业上电解该化合物的熔融物可制得Z单质,Y和Z可形成两种离子化合物,这两种离子化合物的阴离子与阳离子数之比均为1:2。下列说法正确的是
A. 四种元素中至少有两种金属元素
B. 四种元素的常见氢化物中熔点最高的是![]() 的氢化物
的氢化物
C. 四种元素形成的简单高子中,离子半径最小的是元素![]() 形成的离子
形成的离子
D. 常温下,![]() 三种元素形成的化合物的水溶液的
三种元素形成的化合物的水溶液的![]() 小于7
小于7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作回答有关问题:
(1)在盛有![]() 溶液的试管中逐滴滴加少量的
溶液的试管中逐滴滴加少量的![]() 溶液,可观察到的现象是______,该反应的离子方程式为______。
溶液,可观察到的现象是______,该反应的离子方程式为______。
(2)将(1)中所得的混合物平均分成两分,向其中一份中继续滴加![]() 溶液,直至过量,现象是______,反应的离子方程式为______;向另一份中加入足量稀硫酸,现象是______,反应的离子方程式为______。
溶液,直至过量,现象是______,反应的离子方程式为______;向另一份中加入足量稀硫酸,现象是______,反应的离子方程式为______。
(3)(2)中反应说明![]() 所属的物质类别是______。
所属的物质类别是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。反应A:4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g)
2Cl2(g)+2H2O(g)
已知:I.反应A中,4molHCl被氧化,放出115.6kJ热量。
II.
判断下列说法正确的是( )
A. 反应A的△H>-115.6kJ·mol-1
B. H2O中H—O键比HCl中H—Cl键弱
C. 由II中的数据判断氯元素的非金属性比氧元素强
D. 断开1molH—O键与断开1molH—Cl键所需能量相差31.9kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 X、Y、Z、Q、R、E六种前四周期元素中,原子序数X<Y<Z<Q<R<E,其结构或性质信息如表:
元素 | 结构或性质信息 |
X | 原子的L层上s电子数等于p电子数 |
Y | 原子核外的L层有3个未成对电子 |
Z | 地壳中含量最多的元素 |
Q | 单质常温常压下是气体,原子的M层上有1个未成对的p电子 |
R | 核电荷数是Y与Q的核电荷数之和 |
E | N能层上只有一个电子,K、L、M层均排满电子 |
请根据信息回答有关问题:
(1)写出元素Y的原子核外价电子排布图:___________。X的一种氢化物相对分子质量为26,其分子中的σ键与π键的键数之比为______。
(2)X、Y、Z三种元素的第一电离能由高到低的排列为(写元素符号)_____。
(3)X、Z元素分别与氢元素形成的最简单化合物中,沸点较高的为(写化学式)______,原因是________。
(4)XZ与Y2属于等电子体,写出化合物XZ的结构式:_____。
(5)R的一种配合物的化学式为RCl36H2O。已知0.01mol RCl36H2O在水溶液中用过量硝酸银溶液处理,产生0.02mol AgCl沉淀。此配合物最可能是____。
A.[R(H2O)6]Cl3 B.[R(H2O)5Cl]Cl2H2O
C.[R(H2O)4Cl2]Cl2H2O D.[R(H2O)3Cl3]3H2O
(6)向含少量ESO4的水溶液中逐滴滴入氨水,生成蓝色沉淀,反应的离子方程式为:__,继续滴加氨水至过量,沉淀溶解,得到深蓝色溶液,写出反应的离子方程式为:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下在容积为2 L的密闭容器内进行某一反应,容器内气体X、气体Y的物质的量随反应时间变化的曲线如图所示。据图可知( )
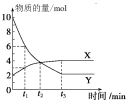
A.反应的化学方程式为4X=Y
B.反应进行到t1时,Y的浓度减少了3 mol/L
C.反应进行到t2时,达到平衡状态
D.反应进行到t3时,每生成4 mol Y的同时生成1 mol X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性溶液 X,可能含有 Al3+、Ba2+、NH4+、Fe2+、Fe3+、CO32-、SO42-、SiO32-、NO3-中的一种或几种离子,取该溶液进行实验,其现象及转化如下图。反应过程中有一种气体是红棕色。请回答下列问题:
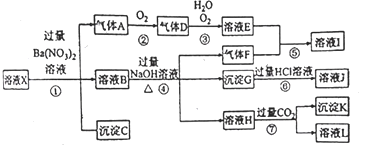
(1)由强酸性条件即可判断溶液X中一定不存在的离子有___________________。
(2)溶液X中,关于NO3-的判断一定正确的是___________。
a.一定有 b.一定没有 c.可能有
(3)产生气体A的离子方程式为________________ ,并用双线桥法表示电子转移的方向和数目。
(4)若转化③中,D、H2O、O2三种物质恰好发生化合反应生成E,则反应中D与O2的物质的量之比为__________。
(5)对不能确定是否存在的离子,可以另取X溶液,加入下列溶液中的—种,根据现象即可判断,该试剂最好是_____________ 。
①NaOH溶液 ②KSCN溶液 ③石蕊试剂 ④pH试纸 ⑤KMnO4溶液⑥氯水和KSCN的混合溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种短周期主族元素,原子序数依次增大。其中B的单质在常温下为双原子分子,它与A的单质可形成气态分子X,X的水溶液呈碱性;D的简单阳离子与X具有相同电子数,且D是同周期元素中原子半径最大的元素;E元素的原子最外层比次外层少两个电子,C、F两种元素的原子最外层共有13个电子。则
(1)X的化学名称为__________。
(2)B单质的结构式为__________;E的气态氢化物的电子式为__________;C与D形成的两种化合物中,其中一种物质含有两种类型的化学键,分别为______________,该物质属于______________(填“离子化合物”或“共价化合物”)。
(3)B、C、E分别与A形成的化合物中最稳定的是__________(写化学式)。
(4)D是同周期简单阳离子中离子半径最__________(填“大”或“小”)的元素。
(5)F的单质在反应中常作________剂(填“氧化”或“还原”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com