
【题目】储氢材料甲由X、Y、Z三种短周期元素组成,Z元素的最外层电子数是X与Y元素最外层电子数之和的1.5倍。为确定甲的组成,进行了如下实验:
①称取5.4g甲固体,加热到250℃时,完全反应后,放出标准状况下3.36 L单质气体乙,同时得到两种固体,其中一种为二元化合物。
②冷却后,向①反应后的固体混合物中加入足量的蒸馏水,充分反应后,又放出标准状况下5.6L单质气体乙,同时得到澄清溶液丙。
请回答:
(1)乙的电子式___。
(2)甲的化学式__。
(3)写出生成溶液丙的化学反应方程式___。
(4)设计实验方案检验溶液丙中的溶质成分___。
【答案】H∶H NaAlH4 2NaH+2Al+4H2O=2NaAlO2+5H2↑ 用洁净的铂丝蘸取丙溶液进行焰色反应,显黄色,证明含Na+;另取少量丙溶液于试管中,逐滴滴加稀盐酸,若出现白色沉淀,继而沉淀消失,则含有AlO2-
【解析】
常见的储氢材料是金属氢化物,加热到250℃时,完全反应后,放出标准状况下3.36 L单质气体乙,气体乙是氢气,所以一定含有H元素;短周期元素中化合价最高的金属元素是+3价Al元素,Z元素的最外层电子数是X与Y元素最外层电子数之和的1.5倍,故Z是
Al元素,则另一种金属元素化合价为+1,反应②得到澄清溶液丙,说明另一种金属元素一定为钠。
(1)常见的储氢材料是金属氢化物,加热到250℃时,完全反应后,放出标准状况下3.36 L单质气体乙,所以一定含有H元素,气体乙是氢气,电子式为H∶H。
(2)①②共生成标准状况下的氢气8.96L÷22.4L/mol=0.4mol,根据得失电子守恒,5.4g甲固体含有0.4molH原子;设5.4g甲固体含有Al元素xmol、Na元素ymol,则![]() ,解得y=0.1、x=0.1, n(Na):n(Al):n(H)=0.1:0.1:0.4=1:1:4,甲的化学式是NaAlH4;
,解得y=0.1、x=0.1, n(Na):n(Al):n(H)=0.1:0.1:0.4=1:1:4,甲的化学式是NaAlH4;
(3)钠的活泼性大于铝,反应①生成的固体是NaH和Al,NaH与水反应生成氢氧化钠和氢气,氢氧化钠与铝反应生成偏铝酸钠和氢气,总反应方程式是2NaH+2Al+4H2O=2NaAlO2+5H2↑。
(4)AlO2-与少量盐酸反应先生成氢氧化铝沉淀,氢氧化铝与盐酸反应生成铝离子,Na+的焰色反应呈黄色;检验溶液丙中的溶质成分的方法是:用洁净的铂丝蘸取丙溶液进行焰色反应,显黄色,证明含Na+;另取少量丙溶液于试管中,逐滴滴加稀盐酸,若出现白色沉淀,继而沉淀消失,则含有AlO2-。


科目:高中化学 来源: 题型:
【题目】在实验室以硼镁矿(含Mg2B2O5·H2O、SiO2及少量Fe2O3、Al2O3)为原料制备硼酸(H3BO3),其流程如图1所示,硫酸镁和硼酸的溶解度随温度的变化曲线如图2所示。
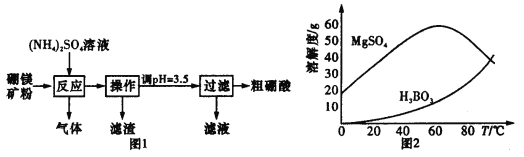
请回答下列问题:
(1)流程中“反应”的实验装置如下图所示:
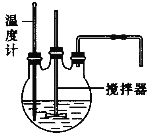
①反应时需控制在95℃进行,控制反应温度的适宜方法是____________________。
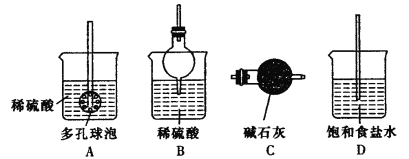
②反应产生的气体需要净化处理,请从下图中选择合适的装置__________(填字母代号)。
(2)实验中得到的粗硼酸还需要重结晶进行提纯,重结晶得到的母液可以在下一次重结晶时重复使用,但达到一定次数后必须净化处理,原因是______________________。
(3)实验时若被强碱溅到,先用大量水冲洗,水洗后再涂上硼酸溶液,写出有关离子方程式:____________。
(4)滴定硼酸时不能直接滴定,因为硼酸是很弱的酸,Ka=5.7×10-10。滴定前,须先将硼酸与甘油作用生成甘油硼酸,Ka=8.4×10-6,然后用酚酞作指示剂,再用NaOH标准溶液滴定。已知硼酸的摩尔质量为61.8 g·mol-1,滴定前称取3.00 g硼酸试样,配成250mL溶液,每次取25.00mL于锥形瓶中滴定,消耗0.200 0 mol·L-1 NaOH标准液的平均体积为20.00 mL。
①计算所得硼酸的纯度=__________。
②若用NaOH标准溶液直接滴定硼酸,则硼酸的纯度将__________(填字母代号)。
A.偏大 B.偏小 C.无影响 D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用0.2mol·L1Al2(SO4)3溶液滴定0.05mol·L1 NaOH溶液。其pHt曲线如图所示。已知0.01mol·L1Al3+时,Al(OH)3沉淀存在的pH范围为4~10。下列说法正确的是( )
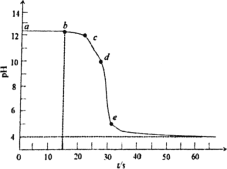
A.曲线段ab为未滴加Al2(SO4)3溶液,溶液只有Na+、OH
B.曲线段bc存在c(Na+)+c(H+)+3c(Al3+)=c(OH)+2c(SO42-)
C.曲线段cd发生反应为Al3++4OH=AlO2-+2H2O
D.曲线段de现象为产生白色沉淀,继而沉淀消失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲酸钠是一种重要的化工原料。在0.5L真空密闭耐压容器中,将预先用95%乙醇水溶液配制的0.2LNaOH溶液加到容器,加热并搅拌,达到60℃恒温时,通入CO到一定压力,开始反应后记录容器压力随时间变化,直到压力不再变化,冷却,泄压,取出反应物,抽滤、烘干并称量。其反应如下:
Ⅰ:CO(g)+H2O(g)![]() HCOOH(aq) ΔH1 K1
HCOOH(aq) ΔH1 K1
Ⅱ:HCOOH(aq)+NaOH(aq)![]() HCOONa(s)+H2O(l) ΔH2 K2
HCOONa(s)+H2O(l) ΔH2 K2
Ⅲ:CO(g)+NaOH(aq)![]() HCOONa(s) ΔH K
HCOONa(s) ΔH K
请回答:
(1)K=___(用K1、K2表示),ΔH=___(用ΔH1、ΔH2表示)。
(2)若需加快反应Ⅲ的速率,下列措施可行的是___。
A.增大CO的初始压力 B.适当升高温度
C.减少乙醇浓度 D.降低搅拌转速
(3)CO的压力转化率可以反映羰基化进程。CO的压力转化率可以表示为:x(CO)=1-![]() ×100%,P0为CO初始压力,P1为CO某时刻分压。HCOONa收率可表示为:Y(HCOONa)=
×100%,P0为CO初始压力,P1为CO某时刻分压。HCOONa收率可表示为:Y(HCOONa)=![]() ×100%,n0(NaOH)表示投料NaOH的物质的量,n(HCOONa)表示生成HCOONa的物质的量。投料比r=
×100%,n0(NaOH)表示投料NaOH的物质的量,n(HCOONa)表示生成HCOONa的物质的量。投料比r=![]() 。
。
保持60℃恒温,以投料比r=0.7时,CO初始压力分别为0.5Mpa、1.5Mpa和2.0Mpa,测得x(CO)与t的关系如图所示。
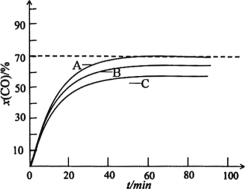
①表示1.5Mpa的曲线为___(用A、B、C表示)。
②若1.5Mpa时,Y(HCOONa)=87%,则NaOH的转化率为___。
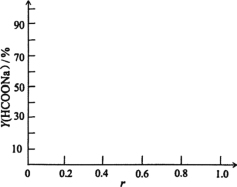
③当CO初始压力为1.5Mpa,保持60℃恒温,不计HCOONa在乙醇中溶解。画出Y(HCOONa)与r示意图___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】混合气体由一种气态烷烃和一种气态烯烃组成,在同温同压下,混合气体对氢气的相对密度为13,在标准状况下,将4.48L混合气体通入足量溴水,溴水质量增重2.8克,通过计算回答:
(1)据题意知混合气体的平均相对分子质量为___,则烷烃分子式为___;
(2)据题意知4.48L混合气体的质量为___克,烷烃的物质的量为___,烯烃的相对分子质量为___;
(3)混合气体中的烯烃分子式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通常利用SiO2 和碳反应来制取硅,写出反应的化学方程式___________________。
工业上还可以利用镁制取硅,反应为2Mg+SiO2 = 2MgO+Si,同时会发生副反应:2Mg + Si = Mg2Si。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:

(1)由于O2和H2O(g)的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用________(填序号)。
a.石灰石 b.锌粒 c.纯碱
(2)实验开始时,必须先通一段时间X气体,再加热反应物,其理由是 ___________________________;当反应引发后,移走酒精灯,反应能继续进行,其原因是______________________。
(3)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因是副产物Mg2Si遇盐酸迅速反应生成SiH4(硅烷)气体,然后SiH4自燃.用化学方程式表示这两个反应①________________________②___________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是部分常见元素的单质及其化合物的转化关系图(有关反应的条件及生成的部分产物已略去)。
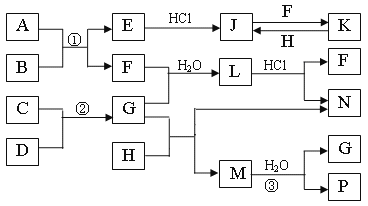
已知:E为红色固体,K为浅绿色溶液;反应②是化工生产中的重要反应;B、C、D、H是单质;B、C、D、F、G、H常温下是气态;F、P和H的水溶液均具有漂白作用,且F是形成酸雨的主要物质之一;N是一种常见的氮肥;化合物G分子构型为三角锥形,化合物M由两种元素组成,分子内共有58个电子。
(1)化合物A中含有的两种元素是___。
(2)F的化学式___;G的水溶液中,最多的阳离子是___。
(3)写出K与H反应的离子方程式:___。
(4)在实验室中,向饱和H水溶液中加入CaCO3粉末,充分反应后过滤,可制得浓度较大的P的水溶液。使用化学平衡移动原理加以解释___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图装置进行实验,将液体A逐滴加入到固体B中,下列叙述正确的是
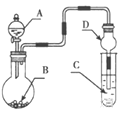
A.若A为H2O2,B为MnO2,C中盛有Na2S溶液, C中溶液变浑浊
B.若A为浓盐酸,B为MnO2,C中盛有KI淀粉溶液,C中溶液变蓝色
C.若A为浓氨水,B为生石灰,C中盛有AlCl 3溶液, C中先产生白色沉淀后沉淀又溶解
D.若A为浓H2SO4 ,B为CaCO3,C中盛有Na2SiO3 溶液,C中溶液出现白色沉淀,证明非金属性S>C>Si
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从废铅蓄电池铅膏(含PbSO4、PbO2和Pb等)中回收铅的一种工艺流程如下:

已知:浓硫酸不与PbO2反应,Ksp(PbCl2)=2.0×10-5,Ksp(PbSO4)=1.5×10-8,PbCl2(s)+2Cl-(aq)=PbCl42-(aq)。下列说法错误的是
A. 合理处理废铅蓄电池有利于资源再利用和防止重金属污染
B. 步骤①中可用浓硫酸代替浓盐酸
C. 步骤①、②、③中均涉及过滤操作
D. PbSO4(s)+2Cl-(aq)![]() PbCl2(s)+SO42-(aq)的平衡常数为7.5×10-4
PbCl2(s)+SO42-(aq)的平衡常数为7.5×10-4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com