
【题目】甲酸钠是一种重要的化工原料。在0.5L真空密闭耐压容器中,将预先用95%乙醇水溶液配制的0.2LNaOH溶液加到容器,加热并搅拌,达到60℃恒温时,通入CO到一定压力,开始反应后记录容器压力随时间变化,直到压力不再变化,冷却,泄压,取出反应物,抽滤、烘干并称量。其反应如下:
Ⅰ:CO(g)+H2O(g)![]() HCOOH(aq) ΔH1 K1
HCOOH(aq) ΔH1 K1
Ⅱ:HCOOH(aq)+NaOH(aq)![]() HCOONa(s)+H2O(l) ΔH2 K2
HCOONa(s)+H2O(l) ΔH2 K2
Ⅲ:CO(g)+NaOH(aq)![]() HCOONa(s) ΔH K
HCOONa(s) ΔH K
请回答:
(1)K=___(用K1、K2表示),ΔH=___(用ΔH1、ΔH2表示)。
(2)若需加快反应Ⅲ的速率,下列措施可行的是___。
A.增大CO的初始压力 B.适当升高温度
C.减少乙醇浓度 D.降低搅拌转速
(3)CO的压力转化率可以反映羰基化进程。CO的压力转化率可以表示为:x(CO)=1-![]() ×100%,P0为CO初始压力,P1为CO某时刻分压。HCOONa收率可表示为:Y(HCOONa)=
×100%,P0为CO初始压力,P1为CO某时刻分压。HCOONa收率可表示为:Y(HCOONa)=![]() ×100%,n0(NaOH)表示投料NaOH的物质的量,n(HCOONa)表示生成HCOONa的物质的量。投料比r=
×100%,n0(NaOH)表示投料NaOH的物质的量,n(HCOONa)表示生成HCOONa的物质的量。投料比r=![]() 。
。
保持60℃恒温,以投料比r=0.7时,CO初始压力分别为0.5Mpa、1.5Mpa和2.0Mpa,测得x(CO)与t的关系如图所示。
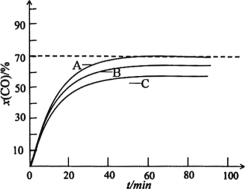
①表示1.5Mpa的曲线为___(用A、B、C表示)。
②若1.5Mpa时,Y(HCOONa)=87%,则NaOH的转化率为___。
③当CO初始压力为1.5Mpa,保持60℃恒温,不计HCOONa在乙醇中溶解。画出Y(HCOONa)与r示意图___。
【答案】K=K1![]() K2 ΔH=ΔH1+ΔH2 AB B 87%
K2 ΔH=ΔH1+ΔH2 AB B 87% 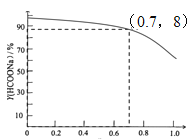
【解析】
(1).Ⅰ:CO(g)+H2O(g)![]() HCOOH(aq)
HCOOH(aq)
Ⅱ:HCOOH(aq)+NaOH(aq)![]() HCOONa(s)+H2O(l)
HCOONa(s)+H2O(l)
反应Ⅰ+反应Ⅱ得反应Ⅲ:CO(g)+NaOH(aq)![]() HCOONa(s) ;
HCOONa(s) ;
(2)根据影响反应速率的因素分析;
(3)①增大压强,平衡正向移动,压强越大,CO的平衡转化率越大;
②根据Y(HCOONa)=![]() ×100%计算NaOH的转化率;
×100%计算NaOH的转化率;
③根据题意,保持60℃恒温,以投料比r=0.7时,CO初始压力为1.5Mpa, Y(HCOONa)=87%,增大氢氧化钠的物质的量,氢氧化钠的转化率减小,随r增大,Y(HCOONa)减小;
(1).Ⅰ:CO(g)+H2O(g)![]() HCOOH(aq)
HCOOH(aq)
Ⅱ:HCOOH(aq)+NaOH(aq)![]() HCOONa(s)+H2O(l)
HCOONa(s)+H2O(l)
反应Ⅰ+反应Ⅱ得反应Ⅲ:CO(g)+NaOH(aq)![]() HCOONa(s) ;所以K=K1
HCOONa(s) ;所以K=K1![]() K2;根据盖斯定律ΔH=ΔH1+ΔH2;
K2;根据盖斯定律ΔH=ΔH1+ΔH2;
(2)A.增大压强,反应速率增大,增大CO的初始压力 ,能加快反应Ⅲ的速率,故选A; B.温度越高反应速率越快,适当升高温度,能加快反应Ⅲ的速率,故选B;
C.反应速率与氢氧化钠浓度有关,所以减少乙醇浓度,不能加快反应Ⅲ的速率,故不选C;
D.降低搅拌转速,反应速率减慢,故不选D。
(3)①增大压强,平衡正向移动,压强越大,CO的平衡转化率越大,所以表示1.5Mpa的曲线为B;
②设氢氧化钠的初始物质的量为amol,Y(HCOONa)=![]() ×100%=87%,则生成甲酸钠的物质的量为0.87amol,消耗氢氧化钠的物质的量是0.87amol, NaOH的转化率为
×100%=87%,则生成甲酸钠的物质的量为0.87amol,消耗氢氧化钠的物质的量是0.87amol, NaOH的转化率为![]() 87%;
87%;
③根据题意,保持60℃恒温,以投料比r=0.7时,CO初始压力为1.5Mpa, Y(HCOONa)=87%,增大氢氧化钠的物质的量,氢氧化钠的转化率减小,随r增大,Y(HCOONa)减小,所以Y(HCOONa)与投料比r的关系示意图为 。
。


科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 1mol任何气体的体积都是22.4L
B. 同温同压下两种气体,只要它们的分子数相同,所占体积也一定相同
C. 在标准状况下,体积为22.4L的物质都是1mol
D. 在非标准状况下,1mol任何气体的体积不可能是22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 X、Y、Z、W均为短周期元素,他们在元素周期表的位置如下图所示。若Y原子的最外层电子数与电子总数之比为3:4,下列说法正确的是

A. 原子半径:W>Z>Y>X
B. 最高价氧化物对应水化物的酸性:Z>W>X
C. 气态氢化物的稳定性:Z>W
D. W的单质能与水反应,生成一种具有漂白性的物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)乙烯的电子式是_____。
(2)2,5-二甲基-2,4-己二烯的结构简式是_____。
(3)分子式为C4H9Cl,核磁共振氢谱只有一组峰的结构简式是_____。
(4)用系统命名法命名下列有机物:
①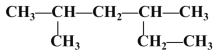 _______。
_______。
②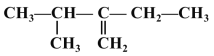 ______。
______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将1 mol A(g)和1 mol B(g)充入2 L密闭容器中发生反应A(g)+B(g)xC(g)+D(s),在t1时达到平衡。在t2、t3时刻分别改变反应的一个条件,测得容器中C(g)的浓度随时间变化如图所示。下列有关说法正确的是

A. 反应方程式中x=2
B. t2时刻改变的条件是使用催化剂
C. t3时刻改变的条件是移去少量D
D. t1~t3间该反应的平衡常数不相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献。他以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱。有关反应的化学方程式为:NH3+CO2+H2O=NH4HCO3;NH4HCO3+NaCl=NaHCO3↓+NH4Cl;2NaHCO3![]() Na2CO3+CO2↑+H2O。
Na2CO3+CO2↑+H2O。
回答下列问题:
(1)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是___(填字母标号)。
a.碳酸氢钠难溶于水
b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(2)某探究活动小组根据上述制碱原理,进行碳酸氢钠的制备实验,同学们按各自设计的方案实验。
①一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如图所示(图中夹持、固定用的仪器未画出)。
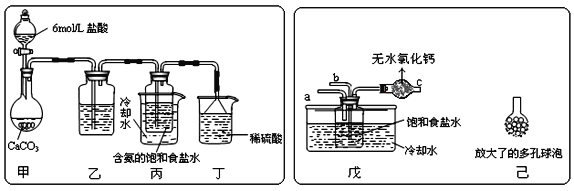
试回答下列有关问题:
(Ⅰ)乙装置中的试剂是___;
(Ⅱ)丁装置中稀硫酸的作用是___;
(Ⅲ)实验结束后,分离出NaHCO3晶体的操作是___(填分离操作的名称)。
②另一位同学用图中戊装置(其它装置未画出)进行实验。
(Ⅰ)实验时,须先从___管通入___气体,再从___管中通入___气体;
(Ⅱ)有同学建议在戊装置的b管下端连接己装置,理由是___;
(3)请你再写出一种实验室制取少量碳酸氢钠的方法:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】储氢材料甲由X、Y、Z三种短周期元素组成,Z元素的最外层电子数是X与Y元素最外层电子数之和的1.5倍。为确定甲的组成,进行了如下实验:
①称取5.4g甲固体,加热到250℃时,完全反应后,放出标准状况下3.36 L单质气体乙,同时得到两种固体,其中一种为二元化合物。
②冷却后,向①反应后的固体混合物中加入足量的蒸馏水,充分反应后,又放出标准状况下5.6L单质气体乙,同时得到澄清溶液丙。
请回答:
(1)乙的电子式___。
(2)甲的化学式__。
(3)写出生成溶液丙的化学反应方程式___。
(4)设计实验方案检验溶液丙中的溶质成分___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是由常见元素组成的一些单质及其化合物之间的转化关系图。各方框表示有关的一种反应物或生成物(部分物质已经略去)。其中A、B、D在常温下均为无色无味的气体,C是能使湿润的红色石蕊试纸变蓝的气体,M是最常见的无色液体。

(1)写出C→E的化学方程式: 。
(2)实验室常用加热两种固体混合物的方法制备物质C,其化学方程式为: ,干燥C常用 (填写试剂名称)。
(3)E物质遇到D物质时,会观察到 现象,若用排水法收集F,则最终集气瓶中收集到的气体为 (填写物质的化学式)。
(4)写出A→D的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 X、Y、Z、Q、R、E六种前四周期元素中,原子序数X<Y<Z<Q<R<E,其结构或性质信息如表:
元素 | 结构或性质信息 |
X | 原子的L层上s电子数等于p电子数 |
Y | 原子核外的L层有3个未成对电子 |
Z | 地壳中含量最多的元素 |
Q | 单质常温常压下是气体,原子的M层上有1个未成对的p电子 |
R | 核电荷数是Y与Q的核电荷数之和 |
E | N能层上只有一个电子,K、L、M层均排满电子 |
请根据信息回答有关问题:
(1)写出元素Y的原子核外价电子排布图:___________。X的一种氢化物相对分子质量为26,其分子中的σ键与π键的键数之比为______。
(2)X、Y、Z三种元素的第一电离能由高到低的排列为(写元素符号)_____。
(3)X、Z元素分别与氢元素形成的最简单化合物中,沸点较高的为(写化学式)______,原因是________。
(4)XZ与Y2属于等电子体,写出化合物XZ的结构式:_____。
(5)R的一种配合物的化学式为RCl36H2O。已知0.01mol RCl36H2O在水溶液中用过量硝酸银溶液处理,产生0.02mol AgCl沉淀。此配合物最可能是____。
A.[R(H2O)6]Cl3 B.[R(H2O)5Cl]Cl2H2O
C.[R(H2O)4Cl2]Cl2H2O D.[R(H2O)3Cl3]3H2O
(6)向含少量ESO4的水溶液中逐滴滴入氨水,生成蓝色沉淀,反应的离子方程式为:__,继续滴加氨水至过量,沉淀溶解,得到深蓝色溶液,写出反应的离子方程式为:__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com