
【题目】苯甲酸乙酯(C9H10O2)稍有水果气味,用于配制香水香精和人造精油,大量用于食品工业中,也可用作有机合成中间体、溶剂等。其制备方法为: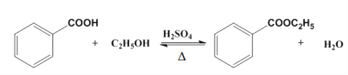
已知:
颜色、状态 | 沸点(℃) | 密度(g·cm-3) | 相对分子质量 | |
苯甲酸* | 白色片状晶体 | 249 | 1.2659 | 122 |
苯甲酸乙酯 | 无色澄清液体 | 212.6 | 1.05 | 150 |
乙醇 | 无色澄清液体 | 78.3 | 0.7893 | 46 |
环己烷 | 无色澄清液体 | 80.8 | 0.7318 | 84 |
*苯甲酸在 100℃会迅速升华。
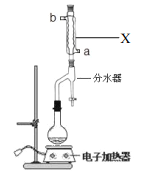
实验步骤如下:
①在 100mL 圆底烧瓶中加入 12.20g 苯甲酸、25mL乙醇(过量)、20mL 环己烷,以及 4mL浓硫酸,混合均匀并加入沸石,按右图所示装好仪器,并在分水器中预先加入水,使水面略低于分水器的支管口,控制温度在 65~70℃加热回流 2h。反应时环己烷-乙醇-水会形成“共沸物”(沸点62.6℃)蒸馏出来。在反应过程中,通过分水器下部的旋塞分出生成的水,注意保持分水器中水层液面原来的高度,使油层尽量回到圆底烧瓶中。
②反应结束,打开旋塞放出分水器中液体后,关闭旋塞。继续加热,至分水器中收集到的液体不再明显增加,停止加热。
③将烧瓶内反应液倒入盛有适量水的烧杯中,分批加入Na2CO3至溶液呈中性。
④用分液漏斗分出有机层,水层用 25mL 乙醚萃取分液,然后合并至有机层。加入氯化钙,对粗产物进行蒸馏,低温蒸出乙醚后,继续升温,接收 210—213℃的馏分。
⑤检验合格,测得产品体积为 11.43mL。
回答下列问题:
(1)装置 X 的作用是_________;进水口为_________(a或者b)。
(2)步骤①中使用分水器不断分离除去水的目的是_________。
(3)步骤②中应控制馏分的温度在_________。
A.65~70℃ B.78~80℃ C.85~90℃ D.215~220℃
(4)若 Na2CO3加入不足,在步骤④蒸馏时,蒸馏烧瓶中可见到白烟生成,产生该现象的原因是_________。
(5)该实验的产率为_________。
【答案】 冷凝回流 a 有利于平衡不断正移,提高产品产率 C 苯甲酸乙酯中混有未除净的苯甲酸,在受热至 100℃时发生升华 80%
【解析】(1)仪器d的名称为冷凝管、水冷凝管或球形冷凝管,为防止高温气体急剧冷却而炸裂冷凝管,则离蒸气温度高的是出水口,离蒸气温度低的是进水口,所以水流方向为a进b出;(2)步骤①中使用分水器不断分离除去水的目的是分离器分离出生成的水,减少生成物从而使该反应向正反应方向移动,提高转化率;(3)由于乙醇的沸点最低,苯甲酸乙酯的沸点高,步骤②中应控制馏分的温度在C.85~90℃;(4)若 Na2CO3加入不足,在步骤④蒸馏时,蒸馏烧瓶中可见到白烟生成,产生该现象的原因是苯甲酸乙酯中混有未除净的苯甲酸,在受热至100℃时发生升华。(5)12.20 g苯甲酸是0.1mol,应该生成苯甲酸乙酯是0.1mol×150g·mol-1=15g。实际生成的是11.43mL×1.05g/ml=12.002g,故产率是12.002÷15×100%=80%。


 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】高纯氧化镁具有优良的性能,广泛应用于各种材料。以某厂工业废液(主要成分为MgCl2,含有少量Fe2+、Fe3+、Mn2+等)为原料制备高纯氧化镁的流程如下:

若要求产品尽量不含杂质,而且生产成本较低,请根据下表提供的数据作答。
25℃时,生成氢氧化物沉淀的pH | 原料价格表 | ||||
物质 | 开始沉淀的pH | 沉淀完全的pH | 物质 | 价格/(元·吨-1) | |
Mg(OH)2 | 10.0 | 11.0 | 漂液(含25.5% NaClO) | 450 | |
Mn(OH)2 | 8.3 | 9.8 | 双氧水(含30% H2O2) | 2400 | |
Fe(OH)2 | 7.6 | 9.6 | 烧碱(含98% NaOH) | 2100 | |
Fe(OH)3 | 2.7 | 3.7 | 纯碱(含99.5% Na2CO3) | 600 | |
(1)漂液中NaClO的电子式为_________________;双氧水中H2O2的结构式为___________。
(2)25℃时,Ksp[Mg(OH)2]=_____________。
(3)“氧化”时,所加试剂X的最佳选择为________________,该步反应的离子方程式为____________。
(4)试剂Y的俗称为__________;“调节pH=9.8”的目的为___________________。
(5)“煮沸”时,反应的化学方程式为_______________________。
(6)常温下,取一定量的试剂Z,加水稀释成1.0 L 0.2 mol·L-1的溶液;再向其中缓慢通入0.05 mol气体A充分反应后,所得溶液中各离子浓度由大到小的顺序为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】几种相邻短周期主族元素的相对位置如表,元素X的原子核外电子数是元素M的2倍,Y的氧化物具有两性。下列说法不正确的是
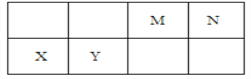
A. 基态Y原子中存在6种能量不同的电子
B. X位于第三周期IIA ,其单质可采用电解熔融其氯化物制备
C. 元素最高价氧化物的水化物中,酸性最强的是HNO3
D. 气体分子(MN)2的电子式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某物质(X)是有机合成中重要中间体,下列关于它的说法正确的是( )
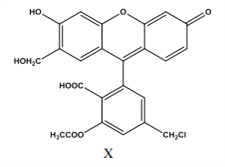
A. 1 mol X 与与足量的 NaOH 溶液反应, 最多消耗 6mol NaOH
B. 1 mol X 最多能与 10mol 氢气反应,且生成物中无手性碳原子
C. 1mol X 与足量的浓溴水反应,最多消耗 2mol Br2
D. X 分子式为 C24H17O8Cl,是芳香族化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在强酸性溶液中能大量共存, 并且溶液为无色透明的离子组是 ( )
A. NH4+ 、Al3+、SO42- 、NO3- B. K+、Fe2+、NO3-、SO42-
C. K+、Cu2+、NH4+ 、Cl- D. Na+ 、K+、NO3- 、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 三氯化碘(ICl3)在药物合成中用途非常广泛,其熔点:33℃,沸点:73℃。实验室可用下图所示装置制取ICl3 :

(1)仪器a 的名称是 。
(2)制备氯气选用的药品为漂白粉固体[主要成分为Ca(ClO)2]和浓盐酸,有关反应的化学方程式为 。
(3)装置B(吸滤瓶)即可用于除杂,也是安全瓶,能监侧实验进行时装置C中是否发生了堵塞。请描述发生堵塞时B中现象 。
(4)试剂X为 。
(5)氯气与单质碘需在温度稍低于70℃下反应,则装置D适宜的加热方式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,有关下列四种溶液的叙述正确的是(忽略溶液混合时体积变化)
① | ② | ③ | ④ | |
pH | 12 | 12 | 2 | 2 |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
A. 在①②中分别加入氯化铵晶体,两溶液的pH值均增大
B. 分别将等体积的①和②加水稀释100倍,所得溶液的pH:①>②
C. 把①④两溶液等体积混合后所得溶液显酸性
D. 将溶液②和溶液③等体积混合,混合后所得溶液pH=7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有X、Y、Z三种金属,将X、Y放在稀硫酸中,用导线连接,电流方向由X到Y。把X放在Z的硫酸盐溶液中,X表面有Z析出。则三种金属的活动性顺序是
A. Y>X>Z B. X>Y>Z C. Z>Y>X D. Z>X>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有属于前四周期的A、B、C、D、E、F、G七种元素,原子序数依次增大。A元素的价电子构型为nsnnpn+1;C元素为最活泼的非金属元素,D元素核外有三个电子层,最外层电子数是核外电子总数的1/6;E元素正三价离子的3d轨道为半充满状态,F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子;G元素与A元素位于同一主族,其某种氧化物有剧毒。
(1)A元素的第一电离能________B元素的第一电离能(填“<”“>”或“=”)。
(2)D元素基态原子核外电子占据的最高能层符号为________, DC2的电子式为__________。
(3)E原子价电子的轨道表示式为_____________________________。
(4)F其基态原子的电子排布式为_____________________,元素位于元素周期表的_______区。
(5)G元素可能的性质是___________(填序号)。
A.其单质可作为半导体材料
B.其电负性大于磷
C.最高价氧化物对应的水化物是强酸
(6)含A、B等元素的化合物的结构如图1所示,该化合物中含有_________(填序号)。
a.极性共价键 b.非极性共价键 c.配位键 d.氢键 e.金属键
(7)A和E形成的一种化合物的晶胞结构如图2所示,该晶胞的化学式为_____________。若两个最近的E原子间的距离为acm,则该晶体的密度是________________g·cm-3。(用NA和a表示)

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com