
【题目】实验室用乙醇与浓硫酸共热制乙烯,常因温度过高生成少量SO2,有人设计了如下图所示实验,以验证上述混合气体中是否含有乙烯和SO2 。

(1)装置中X仪器的名称是____;碎瓷片的作用是____;
(2)写出生成乙烯的反应方程式____;
(3)A、B、C、D装置中可盛放的试剂是(从下列所给试剂中选出,填序号)
①NaOH溶液,②品红溶液,③KMnO4酸性溶液,④FeCl3溶液
A.___ B.___ C.___ D.___
(4)能说明SO2气体存在的现象是_______________;
(5)确证含有乙烯的现象是____________。
【答案】 分液漏斗 防止暴沸 CH3CH2OH![]() CH2=CH2↑+H2O ② ① ② ③ 装置A中品红溶液褪色 装置C中品红溶液不褪色, D中的酸性KMnO4溶液褪色。
CH2=CH2↑+H2O ② ① ② ③ 装置A中品红溶液褪色 装置C中品红溶液不褪色, D中的酸性KMnO4溶液褪色。
【解析】(1)装置中X仪器可通过活塞控制滴加液体的速度来控制反应的快慢,所以它的名称是分液漏斗;实验室制备乙烯所用的原料为乙醇,浓硫酸作催化剂、脱水剂,反应条件是加热到170℃,因乙醇的沸点低,易暴沸,所以加碎瓷片防止暴沸;(2)实验室利用乙醇在浓硫酸的催化作用下发生分子内脱水制取乙烯,乙醇发生了消去反应,反应方程式为:CH3CH2OH![]() CH2=CH2↑+H2O;(3)检验二氧化硫用品红溶液,检验乙烯用高锰酸钾酸性溶液,乙烯和二氧化硫都能使高锰酸钾酸性溶液褪色,所以先检验二氧化硫,然后检验乙烯,在检验乙烯之前用NaOH溶液除尽SO2,再通过品红溶液不褪色确认SO2已除干净,最后用高锰酸钾酸性溶液褪色检验乙烯,因装置A用来检验SO2,试管中品红溶液褪色,说明含有SO2,装置B试管装有NaOH溶液除去SO2,装置C试管通过品红溶液不褪色确认SO2已除干净,装置D 通过高锰酸钾酸性溶液褪色检验乙烯;(4)装置A用来检验SO2,试管中品红溶液褪色,说明含有SO2;(5)因C中无二氧化硫,D中与高锰酸钾溶液作用的为乙烯,所以确证含有乙烯的现象是装置C中的品红溶液不褪色,D中的高锰酸钾溶液褪色。
CH2=CH2↑+H2O;(3)检验二氧化硫用品红溶液,检验乙烯用高锰酸钾酸性溶液,乙烯和二氧化硫都能使高锰酸钾酸性溶液褪色,所以先检验二氧化硫,然后检验乙烯,在检验乙烯之前用NaOH溶液除尽SO2,再通过品红溶液不褪色确认SO2已除干净,最后用高锰酸钾酸性溶液褪色检验乙烯,因装置A用来检验SO2,试管中品红溶液褪色,说明含有SO2,装置B试管装有NaOH溶液除去SO2,装置C试管通过品红溶液不褪色确认SO2已除干净,装置D 通过高锰酸钾酸性溶液褪色检验乙烯;(4)装置A用来检验SO2,试管中品红溶液褪色,说明含有SO2;(5)因C中无二氧化硫,D中与高锰酸钾溶液作用的为乙烯,所以确证含有乙烯的现象是装置C中的品红溶液不褪色,D中的高锰酸钾溶液褪色。


科目:高中化学 来源: 题型:
【题目】【化学一选修3:物质结构与性质】
某原料经测定主要含有A、B、C、D、E五种原子序数依次增大的前四周期元素,其相关信息如下:
元素 | 元素性质或原子结构 |
A | 周期表中原子半径最小的元素 |
B | 原子核外有三种不同的能级且各个能级所填充的电子数相同 |
C | 最外层p轨道半充满 |
D | 位于短周期,其原子的核外成对电子数是未成对电子数的3倍 |
E | 位于ds区且原子的最外层电子数与A的相同 |
请回答下列问题(用A、B、C、D、E所对应的元素符号作答):
(1) B、C、D第一电离能由大到小的顺序为_____。
(2) E的二价离子的电子排布式为_____。
(3) A2B2D4常用作除锈剂,该分子中B的杂化方式为_____;1 mol A2B2D4分子中含有σ键与π键的数目之比为_____。
(4) 与化合物BD互为等电子体的阴离子的化学式为_____(任写一种)。
(5) B2A6、C2A4分子中均含有18个电子,它们的沸点相差较大,主要原因是___。
(6) 一种E和金(Au)形成的合金晶体具有面心立方最密堆积结构,其晶胞中E原子处于面心,Au原子处于顶点,则该合金中E原子与Au原子的个数之比为___;若相临两个Au原子的最短距离为a厘米,则该合金的密度为_____g/cm3。又知上述晶体具有储氢功能,氢原子可进入到由E原子与Au原子构成的四面体空隙中。若将E原子与Au原子等同看待,该晶体储氢后的晶胞结构与CaF2(见图)的结构相似,该晶体储氢后的化学式应为_____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实能用勒夏特列原理解释的是
A.配制FeCl3溶液时加入少量的盐酸
B.钢铁在潮湿的环境中容易生锈
C.工业合成氨时使用铁触媒为催化剂
D.碳跟氧气反应的实验中增加O2的量可以减少CO的生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(17分)
羟甲香豆素是一种治疗胆结石的药物,合成路线如下图所示:

已知: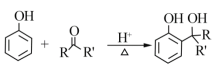
RCOOR'+R'OH![]() RCOOR'+ R'OH(R、R'、R'代表烃基)
RCOOR'+ R'OH(R、R'、R'代表烃基)
(1)A属于芳香烃,其结构简式是______________________。B中所含的官能团是________________。
(2)C→D的反应类型是___________________。
(3)E属于脂类。仅以乙醇为有机原料,选用必要的无机试剂合成E,写出有关化学方程式:______________________________。
(4)已知:2E![]() F+C2H5OH。F所含官能团有
F+C2H5OH。F所含官能团有![]() 和___________。
和___________。
(5)以D和F为原料合成羟甲香豆素分为三步反应,写出有关化合物的结构简式:

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种化工原料,在工业生产中有重要的应用。
Ⅰ.在l.0L恒容密闭容器中投入1 molCO2和2.75molH2发生反应:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图所示,下列说法正确的是_______。
CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图所示,下列说法正确的是_______。


A.该反应的正反应为放热反应
B.压强大小关系为pl<p2<p3
c. M点对应的平衡常数K的值约为1.04×10-2
D.在p2及512K时,图中N点v(正)<v(逆)
Ⅱ.甲醇是基本有机化工原料。甲醇及其可制得的产品的沸点如下。
名称 | 甲醇 | 二甲胺 | 二甲基甲酰胺 | 甲醚 | 碳酸二甲酯 |
结构简式 | CH3OH | (CH3)2NH | (CH3)2NCHO | CH3OCH3 | (CH3O)2CO |
沸点/℃ | 64.7 | 7.4 | 153 | -24.9 | 90 |
(1)在425℃、Al2O3做催化剂,甲醇与氨气反应可以制得二甲胺。二甲胺显弱碱性,与盐酸反应生成(CH3)2NH2Cl,溶液中各离子浓度由大到小的顺序为____________。
(2)甲醇制甲醚的化学方程式为2CH3OH![]() CH3OCH3+H2O,一定温度下,在体积为1.0L的恒容密闭容器中发生该反应。己知387℃时该反应的化学平衡常数K=4,若起始时向容器I中充入0.10molCH3OH、0.15molCH3OCH3和0.10molH2O,则反应将向______(填“正”或“逆”)反应方向进行。
CH3OCH3+H2O,一定温度下,在体积为1.0L的恒容密闭容器中发生该反应。己知387℃时该反应的化学平衡常数K=4,若起始时向容器I中充入0.10molCH3OH、0.15molCH3OCH3和0.10molH2O,则反应将向______(填“正”或“逆”)反应方向进行。
(3)以甲醇为主要原料,电化学合成碳酸二甲酯的工作原理如下图所示。
电源的负极为__________(填“A”或“B”),写出阳极的电极反应_________;若参加反应的O2为1.12m3(标准状况),则制得的碳酸二甲酯的质量为______kg。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述中正确的是( )
A. 标准状况下,22.4LCCl4含有的分子数约为6.02×1023个
B. 1L氢气一定比1L氧气质量少
C. 含有6.02×1023个Fe3+的Fe2(SO4)3中SO42﹣的物质的量为3mol
D. 1molAl3+带有的正电荷数为1.806×1024个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】要检验某溶液中是否含有Cl-,可选用的试剂是 ( )
A. AgNO3溶液和稀硝酸 B. AgNO3溶液
C. AgNO3溶液和稀硫酸 D. AgNO3溶液和稀盐酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com