
【题目】某兴趣小组利用废旧聚乳酸材料制备乳酸铝,方案如下:
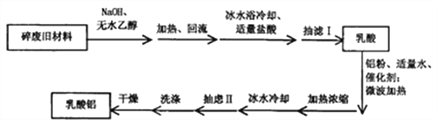
己知:①反应原理:
乳酸常温下为易溶于水、乙醇等溶剂的液体;乳酸铝为白色或黄色粉末状固体,溶于水,不溶于乙醇等有机溶剂。
请回答:
(1)聚乳酸与NaOH加热回流合适的装置是_________,仪器a的名称_________。

(2)其他条件不变调整乳酸溶液质量分数,以及其他条件不变调整乳酸和铝的物质的最之比,得出如下实验数据。根据实验1-3,最合适的(乳酸)为_________。根据实验4-6,n(乳酸):n(铝)最合适的选择为3.025,不考虑实验原料价格,最可能的理由是:_________。
编号 | 时间/h | n(乳酸)∶n(铝) | (乳酸) | 产率(%) | 编号 | 时间/h | n(乳酸)∶n(铝) | (乳酸) | 产率(%) |
1 | 8 | 3.025 | 0.10 | 64.0 | 4 | 10 | 2.935 | 0.20 | 78.4 |
2 | 8 | 3.025 | 0.20 | 72.0 | 5 | 10 | 3.025 | 0.20 | 90.2 |
3 | 8 | 3.025 | 0.30 | 68.5 | 6 | 10 | 3.505 | 0.20 | 91.3 |
(3)抽滤I需对反应容器进行洗涤,并将洗涤液也抽滤。抽虑Ⅱ需对粗产品进行洗涤。所用洗涤剂最合适的分别是_________。
A.抽滤I洗涤剂用热水,抽虑Ⅱ洗涤剂用冷水;
B.抽滤I洗涤剂用滤液,抽虑Ⅱ洗涤剂用滤液;
C.抽滤I洗涤剂先用滤液再用无水乙醇,抽虑Ⅱ洗涤剂用无水乙醇;
D.抽滤I洗涤剂先用无水乙醇再用滤液,抽虑Ⅱ洗涤剂先用无水乙醇再用滤液。
(4)乳酸铝纯度测定方法如下:取ag乳酸铝(相对分子质量294)样品溶解,加入缓冲溶液调节pH值,加入bmLcmol·L-1的EDTA溶液。然后加入指示剂,用d mol·L-1的标准锌溶液滴定过量的EDTA溶液。Al3+和Zn2+与EDTA均1∶1反应。实验消耗标准锌溶液 emL,则乳酸铝纯度为_________。
【答案】 甲 冷凝管 0.20 超过3.025后产率变化不大,而乳酸过量较多反而使得产物杂质较多 C ![]() %
%
【解析】(1)装置甲烧瓶上长导管可作冷凝回流,通过反复回流,可以提高原料利用率,适合聚乳酸与NaOH加热装置,仪器a的名称为冷凝管;
(2)根据实验1-3,(乳酸)为0.20 ,产率最高;根据实验4-6,因n(乳酸):n(铝)超过3.025后产率变化不大,而乳酸过量较多反而使得产物杂质较多,则n(乳酸):n(铝)最合适的选择为3.025;
(3)抽滤I需对反应容器进行洗涤,并将洗涤液也抽滤,洗涤剂可先用滤液洗涤,可减小溶质的操作,且方便、经济,再用无水乙醇,减小产品的损失;抽虑Ⅱ需对粗产品进行洗涤,可直接选择无水乙醇,这样可避免水洗,减小产品的损失,故答案为C。
(4)总EDTA的物质的量为b×10-3L×cmol·L-1=bc×10-3mol,消耗标准锌的物质的量为e×10-3L×dmol·L-1=de×10-3mol,乳酸铝的物质的量为bc×10-3mol-de×10-3mol=(bc-de)×10-3mol,则乳酸铝纯度为![]() ×100%=
×100%= ![]() %。
%。


 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案科目:高中化学 来源: 题型:
【题目】有相同质量的两份NaHCO3粉末,第一份加入足量盐酸,第二份先加热使其完全分解再加足量同质量分数的盐酸,则两者所消耗的盐酸中氯化氢的质量比为
A.2:1 B.1:1 C.1:2 D.3:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)将下列符合要求的组别字母填入相应位置
A.O2和O3 B.![]() C和
C和![]() C C.CH3CH2CH2CH3和
C C.CH3CH2CH2CH3和![]()
D. E.CH3CH2CH2CH3和
E.CH3CH2CH2CH3和![]()
①___________组两种微粒互为同位素。②__________组两种物质互为同素异形体。
③___________组两种物质属于同系物。④___________组两物质互为同分异构体。
⑤___________组两物质是同一物质。
(2)一定温度下,将3 molA气体和1mol B气体通入一容积固定为2L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g),反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,则1min内,B的平均反应速率为__________________;X为________;若反应经2min达到平衡,平衡时C的浓度________ 0.8mol/L(填“大于,小于或等于”)。
xC(g),反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,则1min内,B的平均反应速率为__________________;X为________;若反应经2min达到平衡,平衡时C的浓度________ 0.8mol/L(填“大于,小于或等于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以乙烯为原料,在一定条件下可以转化为A、B、C,最后合成有机化合物D,转化关系如下图所示:
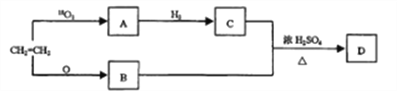
请回答:
(1)写出有机物B的官能团名称:________________。
(2)写出CH3=CH2→A化学方程式:________________。
(3)有机化合物D的相对分子质量为:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用石墨电极完成下列电解实验。
实验装置 | 实验现象 |
| a处试纸变蓝; b处变红,局部褪色; c处无明显变化; d处试纸变蓝 |
下列对实验现象的解释或推测不合理的是
A. a为电解池的阴极
B. b处有氯气生成,且与水反应生成了盐酸和次氯酸
C. c处发生了反应:Fe-3e- = Fe3+
D. d处:2H2O+2e-=H2↑+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是由甲苯合成乙酰水杨酸和酚酞的合成路线。

(1)写出“甲苯→A”的化学方程式____________________。
(2)写出C的结构简式___________,E分子中的含氧官能团名称为__________________;
(3)上述涉及反应中,“E→酚酞”发生的反应类型是______________。
(4)写出符合下列条件的乙酰水杨酸的一种同分异构体的结构简式_________________。
①遇FeCl3溶液显紫色, ②能与碳酸氢钠反应,
③苯环上只有2个取代基的, ④能使溴的CCl4溶液褪色。
(5)写出乙酰水杨酸和NaOH溶液完全反应的化学方程式:___________________。
(6)由D合成E有多步,请设计出D→E的合成路线_________________。(有机物均用结构简式表示)。
(合成路线常用的表示方式为:D![]() ……
……![]() E)
E)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com