
【题目】A由Al2O3、Fe2O3、Al、Cu中的某几种粉木混合而成,设计成份分析实验方案如下,下列分析不正确的是

A. 当m1>m2时,固体中一定存在A1元素
B. 生成蓝色溶液的离子方程式: Cu+2Fe3+=Cu2++2Fe2+
C. 当m2-m3=2.96g,Fe3O4的质量至少为2.32g
D. 溶液a中一定存在c(Na+)>c(A102-)>c(OH-)>c(H+)
【答案】D
【解析】A、当m1>m2时,说明至少有Al2O3、Al两者中的一种,一定存在A1元素,选项A正确;B、Fe3O4与盐酸反应生成氯化铁和氯化亚铁,三价铁离子有强氧化性,发生Cu+2Fe3+═Cu2++2Fe2+,选项B正确;C、引固体质量改变的金属氧化物的溶解,和三价铁与铜单质之间的氧化还原反应,Cu+2Fe3+=Cu2++2Fe2+,Fe3O4~2Fe3+~Cu,也就是四氧化三铁和铜的物质的量大于1:1,m2-m3=2.96g才符合,最小值为1:1,即2.96g×![]() ×100%=2.32 g,选项C正确;D、溶液a中若过量氢氧化钠较多时,可能存在c(Na+)> c(OH-)> c(A102-) >c(H+),选项D不正确。答案选D。
×100%=2.32 g,选项C正确;D、溶液a中若过量氢氧化钠较多时,可能存在c(Na+)> c(OH-)> c(A102-) >c(H+),选项D不正确。答案选D。


科目:高中化学 来源: 题型:
【题目】乙酰基扁桃酰氯是一种医药中间体。某研究小组以甲苯和乙醇为主要原料,按下列路线合成乙酰基扁桃酰氯。
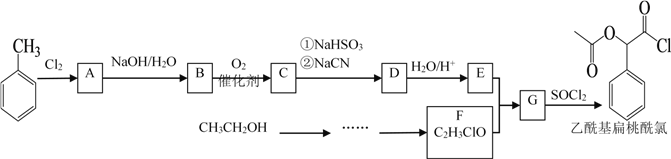
已知: ;
;![]() ;
;
![]()
请回答:
(1)甲苯与氯气反应生成A的反应条件为________, B官能团的名称是_______, D的结构简式_________。
(2) 下列说法正确的是________。
A.化合物A不能发生取代反应
B.化合物B能发生银镜反应
C.化合物C能发生氧化反应
D.从甲苯到化合物C的转化过程中,涉及到的反应类型有取代反应、加成反应和氧化反应
(3) E+F→G的化学方程式是____________________________。
(4)化合物D有多种同分异构体,同时符合下列条件的同分异构体共有____________种,写出其中两种的同分异构体的结构简式____________________________。
①红外光谱检测表明分子中含有氰基(-CN);
②1H-NMR谱检测表明分子中有苯环,且苯环上有两种不同化学环境的氢原子。
(5) 设计以乙醇为原料制备F的合成路线(用流程图表示;无机试剂任选)______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有8种物质:①乙烷;②乙烯;③乙炔;④苯;⑤甲苯;⑥溴乙烷;⑦聚乙烯;⑧环己烯。其中既不能使酸性KMnO4溶液褪色,也不能与溴水反应使溴水褪色的是( )
A. ①②③⑤B. ①④⑥⑦
C. ④⑥⑦⑧D. ②③⑤⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
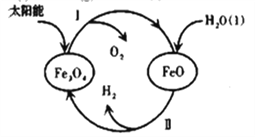
【题目】纳米级Fe3O4呈黑色,因其有磁性且粒度小而在磁记录材料、生物功能材料等诸多领域有重要应用,探究其制备和用途意义重大。
(1)还原-沉淀法:①用还原剂Na2SO3将一定量Fe3+可溶盐溶液中的1/3Fe3+还原,使Fe2+和Fe3+的物质的量比为1:2。②然后在①所得体系中加入氨水,铁元素完全沉淀形成纳米Fe3O4。写出②过程的离子方程式:__________________________。
当还原后溶液中c(Fe2+):c(Fe3+)=2:1时,由下表数据可知,产品磁性最大,可能的原因是___________________________ 。
c(Fe2+):c(Fe3+) | 沉淀性状 | 磁性大小 |
1:3 | 红棕色 | 92.7% |
1:2 | 棕色 | 96.5% |
2:1 | 黑色 | 100% |
(2)电化学法也可制备纳米级Fe3O4,用面积为4cm2的不锈钢小球(不含镍、铬)为工作电极,铂丝作阴极,用Na2SO4溶液作为电解液,电解液的pH维持在10左右,电流50mA。生成Fe3O4的电极反应为________________________。
(3)已知:H2O(l)=H2(g)+1/2O2(g) △H=+285.5kJ·mol-1,以太阳能为热源分解Fe3O4,经由热化学铁氧化合物循环分解水制H2的过程如下,完善以下过程Ⅰ的热化学方程式。
过程Ⅰ:________________________________,
过程Ⅱ:3FeO(s)+H2O(l)=H2(g)+Fe3O4(s) △H=+128.9kJ·mol-1
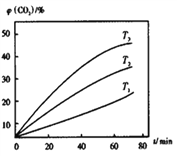
(4)磁铁矿(Fe3O4)常作冶铁的原料,主要反应为:Fe3O4(s)+4CO(g)![]() 3Fe(s)+4CO2(g),该反应的△H<0,T℃时,在IL恒容密闭容器中,加入Fe3O4、CO各0.5mol,10min后反应达到平衡时,容器中CO2的浓度是0.4mol·L-1。
3Fe(s)+4CO2(g),该反应的△H<0,T℃时,在IL恒容密闭容器中,加入Fe3O4、CO各0.5mol,10min后反应达到平衡时,容器中CO2的浓度是0.4mol·L-1。
①T℃时,10min内用Fe3O4表示的平均反应速率为_____g·min-1。
②其他条件不变时,该反应在不同温度下,CO2含量随时间的变化φ(CO2)-t曲线如图所示,温度T1、T2、T3由大到小的关系是_________________,判断依据是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示。据图分析,下列判断错误的是( )
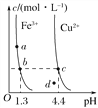
A. Ksp[Fe(OH)3]<Ksp[Cu(OH)2]
B. 加适量NH4Cl固体可使溶液由a点变到b点
C. c、d两点代表的溶液中c(H+)与c(OH-)乘积相等
D. Fe(OH)3、Cu(OH)2分别在b、c两点代表的溶液中达到饱和
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁烯是一种重要的化工原料,可由丁烷催化脱氢制备,正丁烷(C4H10)催化脱氢制1-丁烯(C4H8) 的化学方程式如下:C4H10(g)=C4H8(g)+H2(g)△H,如图是该反应平衡转化率与反应温度及压强的关系图,下列说法正确的是
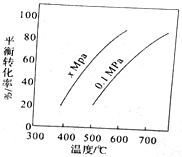
A. x>0.1
B. △H>O
C. 500C时,压强xMPa比0.1MPa条件下的平衡常数大
D. 一定温度下,在一恒容密闭容器中发生该反应,C4H10的浓度越高,平衡转化率越大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某容积为1L的密闭容器中通入1mol CO2和3mol H2,发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH<0。下列有关说法正确的是
CH3OH(g)+H2O(g) ΔH<0。下列有关说法正确的是
A. 该反应在高温下才能自发进行
B. 再加入一定量CO2,则n(CH3OH)/n(CO2)减小
C. 温度升高,反应的平衡常数K增大
D. 当CO2和H2转化率相等时,该反应达到化学平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于元素的说法中,正确的是( )
A.生物体中的化学元素在无机自然界中都可找到
B.在生物体内能找到无机自然界中的所有元素
C.各种元素在地壳中的含量都很丰富
D.不同生物体的元素种类差别很大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】密闭容器中装有1mol NaHCO3和0.8mol Na2O2,加热充分反应后,容器内残留的固体是( )
A. 0.8molNa2CO3和0.6molNaOH B. 0.5molNa2CO3和1molNaOH
C. 0.8molNa2CO3和1molNaOH D. 1molNa2CO3和0.6molNaOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com