
【题目】二氧化氯(化学式:ClO2)是一种高效环保的自来水消毒剂,其中氯和氧两种元素的化合价分别为
A. +2,-2B. +4,-2C. -2,+1D. -4,+2
科目:高中化学 来源: 题型:
【题目】我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献.他以NaCl、NH3、CO2等为原料先制得NaHCO3 , 进而生产出纯碱.有关反应的化学方程式为:NH3+CO2+H2O=NH4HCO3;
NH4HCO3+NaCl=NaHCO3↓+NH4Cl;
2NaHCO3 ![]() Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
(1)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是a.碳酸氢钠难溶于水
b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(2)某探究活动小组根据上述制碱原理,进行碳酸氢钠的制备实验,同学们按各自设计的方案实验.①一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出).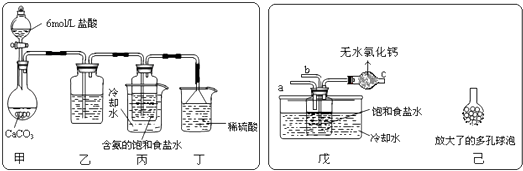
试回答下列有关问题:
(Ⅰ)乙装置中的试剂是;
(Ⅱ)丁装置中稀硫酸的作用是;
(Ⅲ)实验结束后,分离出NaHCO3 晶体的操作是(填分离操作的名称).
②另一位同学用图中戊装置(其它装置未画出)进行实验.
(Ⅰ)实验时,须先从管通入气体,再从管中通入气体;
(Ⅱ)有同学建议在戊装置的b管下端连接己装置,理由是;
(3)请你再写出一种实验室制取少量碳酸氢钠的方法: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴元素的相对原子质量为79.904,自然界中的溴共有两种稳定的同位素,其中一种79Br的原子个数百分含量为50.7%,则另一种溴的同位素可表示为
A.80BrB.81BrC.82BrD.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在向冰醋酸(无水醋酸)加水稀释的过程中,溶液的导电能力(I)随着加入水的体积V变化的曲线如图所示.
请回答:
(1)O点导电能力为0的理由是 .
(2)a、b、c三点处,溶液中c(H+)由小到大的顺序为 .
(3)a、b、c三点处,醋酸电离程度最大的是点.
(4)若使c点溶液中的c(CH3COO﹣)提高,下列措施中不可行的是
A.加热
B.加稀盐酸
C.加固体KOH
D.加水
E.加Zn粒
F.加固体CH3COONa
G.加MgO
I.加固体Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤和煤制品(如水煤气、焦炭、甲醚等)已广泛应用于工农业生产中.
(1)已知:C(s)+H2O(g)=CO(g)+H2(g)△H=+131.3kJ.mol﹣l
CO2(g)+H2(g)=CO(g)+H2O(g)△H=+41.3kJ.mol﹣l
则碳与水蒸气反应生成二氧化碳和氢气的热化学方程式为 , 该反应在(填“高温”、“低温”或“任何温度”)下有利于正向自发进行.
(2)利用炭还原法可处理氮氧化物(如NO等),发生的反应为C(s)+2NO(g)N2(g)+CO2 (g).向某密闭容器中加入一定量的活性炭和NO,在T1℃时,不同时间测得的各气体的浓度如表所示:
时间(min) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
①10~20min内,N2的平均反应速率可v(N2)= .
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是(填字母).
A.通入一定量的NO B.加入一定量的活性炭
C.加入合适的催化剂 D.遁当缩小容器的体积
(3)研究表明,反应CO(g)+H2O(g)H2(g)+CO2(g)的平衡常数随温度的变化如表所示:
温度/℃ | 400 | 500 | 800 |
平衡常数K | 9.94 | 9 | 1 |
若反应在500℃时进行,设起始时CO和H2O的浓度均为0.020molL﹣l , 在该条件下达到平衡时,CO的转化率为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组设计用50mL1.0mol/L盐酸跟50mL1.1mol/L氢氧化钠溶液在如图装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: 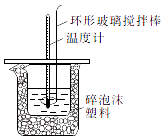
(1)环形玻璃搅拌棒的作用是 .
(2)中和反应放出的热量会造成少量盐酸在反应中挥发,则测得的中和热的数值(填“偏大”、“偏小”或“不变”).
(3)该实验小组做了三次实验,每次取溶液各50mL,并将实验数据记录如表:
实验序号 | 起始温度t1/℃ | 终止温度(t2)℃ | 温差(t2﹣t1)℃ | ||
盐酸 | NaOH溶液 | 平均值 | |||
1 | 25.1 | 24.9 | 25.0 | 31.8 | 6.8 |
2 | 25.1 | 25.1 | 25.1 | 31.8 | 6.7 |
3 | 25.1 | 25.1 | 25.1 | 32.0 | 6.9 |
已知盐酸、NaOH溶液的密度与水相同,中和后生成的溶液的比热容c=4.18×10﹣3kJ/(g℃),则该反应的中和热△H= .
(4)在中和热测定实验中,测量起始温度时需要两个温度计,如果只用一个温度计测量,则测得的中和热的数值(填“偏大”、“偏小”或“不变”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g)2SO3(g)是制备硫酸的重要反应.下列叙述正确的是( )
A.催化剂V2O3不改变该反应的逆反应速率
B.增大反应体系的压强,反应速率一定增大
C.该反应是放热反应,降低温度将缩短反应达到平衡的时间
D.在t1、t2时刻,SO3(g)的浓度分别是c1、c2 , 则时间间隔t1~t2内,SO3(g)生成的平均速率为v= ![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com