
实验室制备少量硫酸亚铁晶体的实验步骤如下:取过量洁净的铁屑,加入20%~30%的稀硫酸溶液,在50℃~80℃水浴中加热至不再产生气泡.将溶液趁热过滤,滤液移至试管中,用橡胶塞塞紧试管口、静置、冷却一段时间后有浅绿色晶体析出,收集产品.
(1)写出该实验制备硫酸亚铁的化学方程式: ▲ ;
(2)采用水浴加热的原因是 ▲ ;
(3)反应时铁屑过量的目的是(用离子方程式表示) ▲ ;
(4)溶液趁热过滤的原因是 ▲ ;
(5)塞紧试管口的目的是 ▲ 。
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:
实验是化学研究的基础,关于下列各实验装置图的叙述中,正确的是
 |
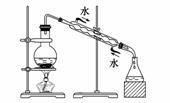
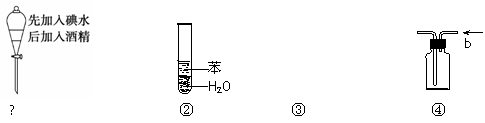 |
A.溶液上层无色,下层紫红色
B.装置②可用于吸收HCl气体,并防止倒吸
 C.装置③可用于制取蒸馏水
C.装置③可用于制取蒸馏水
D.装置④ b口进气可收集H2、CO2等气体
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究性学习小组为了研究影响化学反应速率的因素,设计如下方案:
| 实验编号 | 0.01mol•L﹣1 酸性KMnO4溶液 | 0.1mol•L﹣1 H2C2O4溶液 | 水 | 1mol•L﹣1 MnSO4溶液 | 反应温度/℃ | 反应时间 |
| I | 2ml | 2ml | 0 | 0 | 20 | 125 |
| II | ▲ | ▲ | 1ml | 0 | 20 | 320 |
| III | ▲ | ▲ | ▲ | 0 | 50 | 30 |
| IV | 2ml | 2ml | 0 | 2滴 | 20 | 10 |
反应方程式:2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O
(1)实验计时方法是从溶液混合开始记时,至 ▲ 时记时结束。
(2)实验I和II研究浓度对反应速率的影响,实验I和III研究温度对反应速率的影响.请在上表空格中填入合理的实验数据.
(3)从实验数据分析,实验I和IV研究 ▲ 对反应速率的影响.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于有机物结构、性质的说法正确的是
A.石油的分馏、裂化和煤的干馏都是化学变化
B.乙烯分子与苯分子都能与H2发生加成反应,说明二者所含碳碳键相同
C.甲烷、苯、乙醇、乙酸和乙酸乙酯在一定条件下都能发生取代反应
D.蔗糖、油脂、蛋白质都能发生水解反应,都属于天然有机高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素X、Y、Z在元素周期表中的位置如右下图所示,下列说法错误的是
A.X、Y、Z三种元素中,Y的非金属性最强
B.Y的氢化物的稳定性比Z的氢化物强
C.Z的最高正化合价为+6
D.常压下Z的单质的熔点比Y的低

查看答案和解析>>
科目:高中化学 来源: 题型:
欲观察环戊烯( )是否能使酸性KMnO4溶液褪色,先将环戊烯溶于适当的溶剂,再慢慢滴入0.005mol·L-1 KMnO4溶液并不断振荡。下列哪一种试剂最适合用来溶解环戊烯做此实验( )
)是否能使酸性KMnO4溶液褪色,先将环戊烯溶于适当的溶剂,再慢慢滴入0.005mol·L-1 KMnO4溶液并不断振荡。下列哪一种试剂最适合用来溶解环戊烯做此实验( )
A.四氯化碳 B.裂化汽油 C.甲苯 D.水
查看答案和解析>>
科目:高中化学 来源: 题型:
25℃和101kPa时,乙烷、乙炔和丙烯组成的混合烃32mL,与过量氧气混合并完全燃烧,除去水蒸气,恢复到原来的温度和压强,气体总体积缩小了72mL,原混合烃中乙炔的体积分数为 ( )
A. 25% B. 50% C. 75% D. 12.5%
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,将PCl3(g)和Cl2(g)充入体积不变的2L密闭容器中发生下述反应:PCl3(g) +Cl2(g) 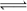 PCl5(g);5min末达到平衡,有关数据如下表。
PCl5(g);5min末达到平衡,有关数据如下表。
| PCl3(g) | Cl2(g) | PCl5(g) | |
| 初始浓度(mol•L—1) | 2.0 | 1.0 | 0 |
| 平衡浓度(mol•L—1) | C1 | C2 | 0.4 |
下列判断不正确的是
A.若升高温度,反应的平衡常数减小,则正反应为吸热
B.反应5min内,v(PCl3)=0.08 mol•L-1•min-1
C.当容器中Cl2为1.2mol时,可逆反应达到平衡状态
D.平衡后移走2.0mol PCl3和1.0mol Cl2,在相同条件下再达平衡时,c(PCl5)<0.2 mol•L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com