
在一定条件下,将PCl3(g)和Cl2(g)充入体积不变的2L密闭容器中发生下述反应:PCl3(g) +Cl2(g) 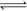 PCl5(g);5min末达到平衡,有关数据如下表。
PCl5(g);5min末达到平衡,有关数据如下表。
| PCl3(g) | Cl2(g) | PCl5(g) | |
| 初始浓度(mol•L—1) | 2.0 | 1.0 | 0 |
| 平衡浓度(mol•L—1) | C1 | C2 | 0.4 |
下列判断不正确的是
A.若升高温度,反应的平衡常数减小,则正反应为吸热
B.反应5min内,v(PCl3)=0.08 mol•L-1•min-1
C.当容器中Cl2为1.2mol时,可逆反应达到平衡状态
D.平衡后移走2.0mol PCl3和1.0mol Cl2,在相同条件下再达平衡时,c(PCl5)<0.2 mol•L-1
【知识点】化学平衡的移动、反应速率
【答案解析】 A 解析:A、升高温度,反应的平衡常数减小,平衡向逆反应移动,故正反应为放热反应,故A错误;
B、由表中数据可知,平衡时△c(PCl5)=0.4mol/L,根据方程式可知△c(PCl3)=0.4mol/L,v(PCl3)=0.4mol/L÷5min=0.08 mol•L-1•min-1,故B正确;
C、平衡时△c(PCl5)=0.4mol/L,根据方程式可知△c(Cl2)=0.4mol/L,△n(Cl2)=0.4mol/L×2L=0.8mol,故平衡时Cl2的物质的量为1mol/L×2L-0.8mol=1.2mol,故C正确;
D、平衡后移走2.0mol PCl3和1.0mol Cl2到达的平衡,等效为开始PCl3为1mol/L、Cl2为0.5mol/L到达平衡,反应物的浓度变为原平衡的一半,与原平衡相比,压强降低,平衡向逆反应移动,反应物转化率降低,故相同条件下再达平衡时,c(PCl5)<0.2 mol•L-1,故D正确;
故答案选A
【思路点拨】本题考查化学平衡常数的应用、化学平衡的有关计算等,难度中等,注意D选项中构建平衡建立的途径。


 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:
一密闭体系中发生反应:2SO2(g)+O2(g)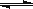 2SO3(g),右图表示该反应的速率(v)在某一时间(t)段内的变化。则下列时间段中,SO3的百分含量最高的是( )
2SO3(g),右图表示该反应的速率(v)在某一时间(t)段内的变化。则下列时间段中,SO3的百分含量最高的是( )
A. t0→t1 B. t2→t3
C. t3→t4 D. t5→t6

查看答案和解析>>
科目:高中化学 来源: 题型:
实验室制备少量硫酸亚铁晶体的实验步骤如下:取过量洁净的铁屑,加入20%~30%的稀硫酸溶液,在50℃~80℃水浴中加热至不再产生气泡.将溶液趁热过滤,滤液移至试管中,用橡胶塞塞紧试管口、静置、冷却一段时间后有浅绿色晶体析出,收集产品.
(1)写出该实验制备硫酸亚铁的化学方程式: ▲ ;
(2)采用水浴加热的原因是 ▲ ;
(3)反应时铁屑过量的目的是(用离子方程式表示) ▲ ;
(4)溶液趁热过滤的原因是 ▲ ;
(5)塞紧试管口的目的是 ▲ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
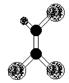
据调查,劣质的家庭装饰材料会释放出近百种能引发疾病的有害物质,其中一种有机物分子的球棍模型如右图,图中“棍”代表单键或双键或三键,不同大小的球代表不同元素的原子,且三种元素位于不同的短周期。下面关于该有机物的叙述不正确的是( )
A.有机物化学式为C2HCl3
B.分子中所有原子在同一平面内
C.该有机物难溶于水
D.可由乙炔与氯化氢加成得到
查看答案和解析>>
科目:高中化学 来源: 题型:
有机化学反应因反应条件不同,可生成不同的有机产品。例如:
HX + 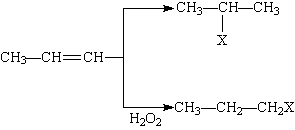 (X为卤素原子)
(X为卤素原子)
工业上利用上述信息,按下列路线合成结构简式为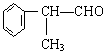 的物质,该物质是一种香料。
的物质,该物质是一种香料。
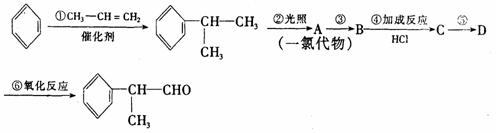
请根据上述路线,回答下列问题:
(1)A的结构简式可能为____________________________________。
(2)反应①、③、⑤的反应类型分别为________、________、_______。
(3)反应④的化学方程式为(有机物写结构简式,并注明反应条件):
_________________________________________________________。
(4)工业生产中,中间产物A须经反应③④⑤得D,而不采取直接转化为D的方法,其原因是_______________________________________。
(5)这种香料具有多种同分异构体,其中某些物质有下列特征:①其水溶液遇FeCl3溶液呈紫色 ②分子中有苯环,且苯环上的一溴代物有两种。写出符合上述条件的物质可能的结构简式(只写两种):
_____________________________,_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
肼是重要的化工原料。某探究小组利用下列反应制取水合肼(N2H4·H2O)。
 CO(NH2)2+ 2NaOH + NaClO = Na2CO3 + N2H4·H2O + NaCl
CO(NH2)2+ 2NaOH + NaClO = Na2CO3 + N2H4·H2O + NaCl
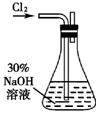
实验一: 制备NaClO溶液。(实验装置如右图所示)
(1)配制30%NaOH溶液时,所需玻璃仪器除量筒外还有 (填标号)。
A.容量瓶 B.烧杯 C.烧瓶 D.玻璃棒
(2) 锥形瓶中发生反应的化学方程式是 。
 (3) 因后续实验需要,需利用中和滴定原理测定反应后锥形瓶中混合溶液的NaOH的浓度。请选用所提供的试剂(H2O2溶液、FeCl2溶液、0.1000mol·L-1盐酸、酚酞试液),设计实验方案。
(3) 因后续实验需要,需利用中和滴定原理测定反应后锥形瓶中混合溶液的NaOH的浓度。请选用所提供的试剂(H2O2溶液、FeCl2溶液、0.1000mol·L-1盐酸、酚酞试液),设计实验方案。
。
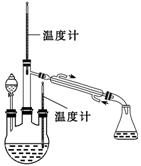
实验二: 制取水合肼。(实验装置如右图所示)
控制反应温度,将分液漏斗中溶液缓慢滴入三颈烧瓶中,充分反应。
加热蒸馏三颈烧瓶内的溶液,收集108~114℃馏分。
(已知:N2H4·H2O + 2NaClO = N2↑ + 3H2O + 2NaCl)
(4)分液漏斗中的溶液是 (填标号)。
A.CO (NH2) 2溶液 B.NaOH和NaClO混合溶液
选择的理由是 。
实验三: 测定馏分中肼含量。
称取馏分5.000g,加入适量NaHCO3固体,加水配成250mL溶液,移出25.00mL,用0.1000mol·L-1的I2溶液滴定。滴定过程中,溶液的pH保持在6.5左右。
(已知:N2H4·H2O + 2I2 = N2↑+ 4HI + H2O)
(5)滴定过程中,NaHCO3能控制溶液的pH在6.5左右,原因是 。
(6)实验测得消耗I2溶液的平均值为18.00mL,馏分中水合肼(N2H4·H2O)的质量分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示是分离混合物时常用的仪器,从左至右,可以进行的混合物分离操作分别是( )
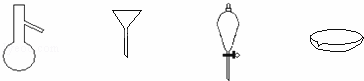
|
| A. | 蒸馏、蒸发、萃取、过滤 | B. | 蒸馏、过滤、萃取、蒸发 |
|
| C. | 萃取、过滤、蒸馏、蒸发 | D. | 过滤、蒸发、萃取、蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,对于反应N2(g)+3H2(g)  2NH3(g) ΔH=-92.4 kJ·mol-1。N2的平衡转化率(α)与体系总压强(p)的关系如图所示。下列说法正确的是
2NH3(g) ΔH=-92.4 kJ·mol-1。N2的平衡转化率(α)与体系总压强(p)的关系如图所示。下列说法正确的是
A.将1 mol氮气、3 mol氢气,置于1 L密闭容器中发生反应,放出的热量 为92.4 kJ
为92.4 kJ
B.平衡状态由A变到B时,平衡常数K(A)<K(B)
C.上述反应在达到平衡后,增 大压强,H2的转化率增大
大压强,H2的转化率增大
D.升高温度,平衡向逆反应方向移动,说明逆反应速率增大,正反应速率减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com