
(14分)常温下钛的化学活性很小,在较高温度下可与多种物质反应。工业上由金红石(含TiO2大于96%)为原料生产钛的流程如下:

(1)TiCl4遇水强烈水解,写出其水解的化学方程式 。
(2)①若液氯泄漏后遇到苯,在钢瓶表面氯与苯的反应明显加快,原因是 。
②Cl2含量检测仪工作原理如下图,则Cl2在Pt电极放电的电极反应式为 。

③实验室也可用KClO3和浓盐酸制取Cl2,方程式为:KClO3 + 6HCl(浓) = KCl + 3Cl2↑ + 3H2O。
当生成6.72LCl2(标准状况下)时,转移的电子的物质的量为 mol。
(3)一定条件下CO可以发生如下反应:4H2(g)+2CO(g)  CH3OCH3(g)+H2O(g) △H。
CH3OCH3(g)+H2O(g) △H。
①该反应的平衡常数表达式为K= 。
②将合成气以n(H2)/n(CO)=2通入1 L的反应器中,CO的平衡转化率随温度、压强变化关系如图所示,下列判断正确的是 (填序号)。

a.△H <0
b.P1<P2<P3
c.若在P3和316℃时,起始时n(H2)/n(CO)=3,则达到平衡时,CO转化率小于50%
③采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和H2制备二甲醚(简称DME)。观察下图回答问题。

催化剂中n(Mn)/n(Cu)约为 时最有利于二甲醚的合成。
(14分)
(1)TiCl4 + 4H2O=Ti(OH)4↓+ 4HCl↑或TiCl4 + 3H2O=H2TiO3↓+ 4HCl↑(2分)
(2)①铁与氯气反应生成的氯化铁,对氯与苯的反应有催化作用 (2分)
②Cl2 + 2e- + 2Ag+ == 2AgCl (2分) ③0.5 (2分)
(3)①c(CH3OCH3)c(H2O)/[c(H2)4c(CO)2] (2分)
②a(2分) ③2.0 (2分,1.9~2.1均给分)
【解析】
试题分析:(1) TiCl4遇水强烈水解,生成氯化氢和氢氧化钛,化学方程式是TiCl4 + 4H2O=Ti(OH)4↓+ 4HCl↑;或TiCl4 + 3H2O=H2TiO3↓+ 4HCl↑;
(2)①氯气与钢瓶中的铁反应生成的氯化铁对氯气与苯的反应有催化作用,所以钢瓶表面氯与苯的反应明显加快;
②根据图可知,银离子向通入氯气的一极移动,说明通入氯气的一极是阴极,所以氯气得到电子生成氯离子与银离子反应生成氯化银沉淀,电极反应式是Cl2 + 2e- + 2Ag+ == 2AgCl;
③根据KClO3 + 6HCl(浓) = KCl + 3Cl2↑ + 3H2O,当生成6.72LCl2(标准状况下)物质的量是0.3mol时,消耗氯酸钾的物质的量是0.1mol,氯酸钾中Cl元素的化合价从+5价降低到0价,得到5个电子,则0.1mol氯酸钾参加反应得到电子的物质的量是0.5mol,所以该过程中转移的电子的物质的量为0.5mol;
(3)①根据平衡常数的定义,可知该反应的平衡常数可表示为K= c(CH3OCH3)c(H2O)/[c(H2)4c(CO)2];
②a、压强一定时,温度升高,CO的转化率降低,说明升高温度,平衡逆向移动,则该反应是放热反应,△H <0,正确;b、压强增大,平衡正向移动,则CO的转化率增大,所以P1>P2>P3,错误;c、若在P3和316℃时,起始时n(H2)/n(CO)=3,即增大氢气的浓度而CO的浓度不变,则平衡正向移动,所以达到平衡时CO的转化率增大,大于50%,错误,答案选a;
③根据图可知,当CO的转化率最大、DME的选择性最大值时对应的横坐标大约在2.0附近,所以n(Mn)/n(Cu)约为2.0时最有利于二甲醚的合成。
考点:考查对物质性质的分析,化学平衡移动的判断,对图像的分析判断


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2014-2015江苏省宿迁市高二下学期学业水平模拟化学试卷(解析版) 题型:选择题
将0.1 mol N2和0.3 mol H2置于密闭容器中发生反应:N2+3H2 2NH3,下列关于该反应的说法中正确的是
2NH3,下列关于该反应的说法中正确的是
A.增大压强,反应速率减小
B.最终可生成0.2 mol NH3
C.升髙温度,反应速率增大
D.当V正(N2):V 正(H2)=1:3时,一定达化学平衡状态
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省菏泽市高三上学期期末考试化学B试卷(解析版) 题型:选择题
下列描述正确的是
A.氯气、活性炭都能使品红溶液褪色,它们的漂白原理相同
B.滴加石蕊试液显红色的溶液:Fe3+、NH4+、I-可能大量共存
C.某溶液中加入盐酸酸化的氯化钡产生白色沉淀,原溶液中一定含有SO42-
D.Fe(NO3)2溶液中滴加少量稀硫酸会变黄色
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省德州市高三2月期末统考化学试卷(解析版) 题型:选择题
下列叙述正确的是
A.工业上电解熔融的Al2O3冶炼铝用铁做阳极
B.用惰性电极电解Na2SO4溶液,阴、阳两极产物的物质的量之比为1:2
C.用惰性电极电解饱和NaCl溶液,若有1 mol电子 转移,则生成2 molNaOH
转移,则生成2 molNaOH
D.用惰性电极电解CuSO4溶液一段时间后,加入CuO固体可以使CuSO4溶液恢复原来浓度
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省德州市高三2月期末统考化学试卷(解析版) 题型:选择题
仅用下表提供的玻璃仪器(非玻璃仪器和药品任选),不能实现相应实验目的的是
选项 | 实验目的 | 玻璃仪器 |
A. | 验证Na2CO3和NaHCO3的热稳定性 | 酒精灯、试管、导气管 |
B | 实验室用浓氨水和生石灰制备氨气 | 普通漏斗、烧杯、玻璃棒 |
C | 测定NaOH溶液浓度 | 滴定管、锥形瓶、烧杯 |
D | 分离乙醇和乙酸乙酯的混合物 | 分液漏斗、烧杯 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省泰州市姜堰区高三下学期期初联考化学试卷(解析版) 题型:选择题
一定条件下进行反应:A(g) B(g)+C (g),向2.0 L恒容密闭容器中充入1.0 mol A(g),经过一段时间后达到平衡。反应过程中测得的有关数据见下表:
B(g)+C (g),向2.0 L恒容密闭容器中充入1.0 mol A(g),经过一段时间后达到平衡。反应过程中测得的有关数据见下表:
t/s | 0 | 2 | 4 | 6 | 8 |
n(B)/mol | 0 | 0.30 | 0.39 | 0.40 | 0.40 |
下列说法正确的是
A.反应前2min的平均速率v(B)=0.15 mol/(L·min)
B.保持其他条件不变,升高温度,平衡时c(B)=0.22 mol·L-1,则反应的ΔH < 0
C.保持其他条件不变,起始向容器中充入2.0 mol A,反应达到平衡时C的体积分数减小
D.保持其他条件不变,起始向容器中充入1.2 mol A、0.60 mol B和0.60 mol C,反应达到平衡前的速率:v(正)<v(逆)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省泰州市姜堰区高三下学期期初联考化学试卷(解析版) 题型:选择题
下列各组物质中,不满足组内任意两种物质在一定条件下均能发生反应的是
物质 组别 | 甲 | 乙 | 丙 |
A | FeCl2 | Cl2 | NaOH |
B | SiO2 | NaOH | HF |
C | AlCl3 | KOH | H2SO4 |
D | SO2 | NaOH | NaHCO3 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省五市十校高三下学期3月模拟考试理综化学试卷(解析版) 题型:选择题
乙酸橙花酯是一种食用香料,其结构简式如图所示,关于该有机物的下列叙述中正确的是
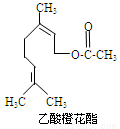
①分子式为C12H20O2
②能使酸性KMnO4溶液褪色
③能发生加成反应,但不能发生取代反应
④它的同分异构体中可能有芳香族化合物,且属
于芳香族化合物的同分异构体有8种
⑤1mol该有机物水解时只能消耗1molNaOH
⑥1mol该有机物在一定条件下和H2反应,共消耗H2为3mol
A.①②③ B.①②⑤ C.①②⑤⑥ D.①②④⑤⑥
查看答案和解析>>
科目:高中化学 来源:2014-2015广东省肇庆市高一上学期期末考试化学试卷(解析版) 题型:选择题
下列有关离子的检验方法和判断正确的是
A.向某溶液中滴加KSCN溶液,若溶液出现血红色则说明原溶液中含Fe3+
B.向某溶液中滴加BaCl2溶液,若有白色沉淀,再滴加足量稀HNO3,若沉淀不溶解,则说明原溶液中一定含Ag+
C.向某溶液中滴加足量稀HCl,产生气体能使澄清石灰水变浑浊,则说明原溶液中一定含CO32-
D.用铂丝蘸取某溶液在酒精灯火焰上灼烧直接观察火焰颜色,未见紫色,说明原溶液中不含K+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com