
【题目】一定条件下,在密闭容器中发生反应:2CO(g)![]() C(s)+CO2(g)。
C(s)+CO2(g)。

①下列能说明该反应达到平衡的是___________。
A.CO和CO2的浓度之比为1∶1
B.CO和CO2的物质的量之比不再变化
C.混合气体的平均摩尔质量不再变化
D.形成amolC=O键的同时断裂amolC![]() O键
O键
②向某恒容容器中通入一定量的CO发生上述反应,在不同温度下CO2的物质的量浓度c(CO2)随温度的变化如上图所示,则该反应为________(填“放热”或“吸热”)反应。
③向容积可变的某恒压容器中通入amolCO,T℃时反应经过10min达平衡,CO的体积分数为75%。CO的平衡转化率为_______。在容积改变的条件下,反应速率可用单位时间内反应物或生成物的物质的量变化来表示,则0-10min内平均反应速率v(CO2)=__________。
【答案】BC放热40%0.02a mol·min-1
【解析】
①A.CO和CO2的浓度之比为1:1,可能是反应进行到某一时刻的情况,不一定是平衡状态,故A不能判断该反应达到化学平衡状态;
B.CO和CO2的物质的量之比不再变化,说明各物质的浓度保持不变,故B能判断该反应达到化学平衡状态;
C.此反应是反应前后气体体积改变的反应,反应体系中有固体物质,气体总物质的量也发生改变,当容器内混合气体的平均摩尔质量不再变化,说明反应达到平衡,故C能判断该反应达到化学平衡状态;
D.形成amolC=O键,即生成![]() molCO2,为正反应;断裂amolC
molCO2,为正反应;断裂amolC![]() O键,即消耗amolCO,为也正反应,故D不能判断该反应达到化学平衡状态;
O键,即消耗amolCO,为也正反应,故D不能判断该反应达到化学平衡状态;
故答案为:BC;
②T3对应的点为刚达到平衡点,T3对应的点后为平衡受温度影响的情况,即升温,CO2的物质的量浓度c(CO2)减小,平衡左移,故正反应的![]() H<0,则该反应为放热反应。
H<0,则该反应为放热反应。
故答案为:放热;
③设转化的CO的物质的量为xmol,则:
2CO(g)![]() C(s)+CO2(g)
C(s)+CO2(g)
起始(mol) a 0 0
变化(mol) x ![]()
![]()
平衡(mol) a-x ![]()
![]()
依据题意有,![]() 100%=75%,解得:x=0.4a。
100%=75%,解得:x=0.4a。
CO的平衡转化率为:![]() 100%=
100%=![]() 100%= 40%;
100%= 40%;
0-10min内平均反应速率v(CO2)=![]() =
=![]() = 0.02a mol·min-1。
= 0.02a mol·min-1。
故答案为:40%;0.02a mol·min-1。


 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:
【题目】钒是人体必需的微量元素,能预防突发性心脏病等疾病,常见化合价有+2、+3、+4和+5。实验室模拟工业生产制备V2(CO3)3的步骤如下:
①取18.20gV2O5放入水中搅拌形成悬浊液,通入二氧化硫充分反应可得V2(SO4)3溶液。
②将V2(SO4)3溶液与足量的碳酸钠溶液混合,充分反应后过滤洗涤、干燥,得V2(CO3)3固体22.56g。
已知:+5价Ⅴ具有氧化性,+3价V具有还原性,易被氧气氧化。
回答下列问题:
(1)实验室用Na2SO3固体和H2SO4(浓)制取SO2,可选用的发生装置是___________(填A或B),若利用下述装置制取并收集干燥的SO2,连接顺序为a→___________→___________→___________→___________→f。

(2)步骤①实验装置如下:
①图中利用水浴处理的优点是___________,装置C中长颈漏斗的作用是___________。
②通入二氧化硫前和实验结束后都要通入N2,目的是___________。
③写出仪器D中反应的离子方程式___________。

(3)步骤②中洗涤操作后,证明已经洗净的操作是___________,本实验中的产率为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】日常生活中,许多现象与氧化还原反应有关,下列现象与氧化还原反应无关的是
A. 铜质奖章上出现铜绿[Cu2(OH)2CO3]
B. 充有H2的“喜羊羊”娃娃遇明火发生爆炸
C. 大理石雕像被酸雨腐蚀毁坏
D. 轮船底部生锈
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关实验方法及现象的下列说法中正确的是( )
A.用洁净的铂丝蘸取少量溶液在酒精灯火焰上灼烧,火焰呈黄色,则溶液中一定不含有![]()
B.取![]() 溶液,向其中加入
溶液,向其中加入![]()
![]() 溶液,通过检验
溶液,通过检验![]() 的存在来说明该反应有一定的限度
的存在来说明该反应有一定的限度
C.把分别研磨后的20g![]() 和
和![]() 晶体混合,用玻璃棒搅拌充分反应,反应混合物的温度会明显下降
晶体混合,用玻璃棒搅拌充分反应,反应混合物的温度会明显下降
D.在某溶液中加入氯化钡溶液,再加入足量的稀盐酸,若有白色浑浊出现,则说明原溶液中存在![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属-空气电池是以金属为燃料,与空气中的氧气发生氧化还原反应产生电能的一种特殊燃料电池。如图为钠-空气电池的装置示意图,其中电解液为含NaPF6的有机电解液,可传导Na+.下列说法正确的是( )
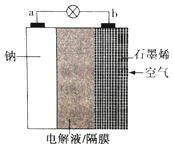
A.装置中电子转移途径:![]() 导线
导线![]() 电解液
电解液![]()
B.b电极为正极,发生还原反应
C.可用氯化钠水溶液代替该有机电解液
D.b电极的电极反应式:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,改变饱和氯水的pH,得到部分含氯微粒的物质的量分数与pH的关系如图所示。下列叙述不正确的是

A. 该温度下,HClO![]() H++ClO-的电离常数Ka的对值lgKa= -7.54
H++ClO-的电离常数Ka的对值lgKa= -7.54
B. 氯水中的Cl2、ClO-、HClO均能与KI发生反应
C. pH=1的氯水中,c(Cl2)>c(Cl3-)>c(HClO)>c(ClO-)
D. 已知常温下反应Cl2(aq)+Cl-(aq)![]() Cl3-(aq)的K=0.191,当pH增大时,K减小
Cl3-(aq)的K=0.191,当pH增大时,K减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸锌被广泛应用于医药领域和工农业生产。工业上由氧化锌矿(主要成分为ZnO,另含ZnSiO3、FeCO3、CuO等)生产ZnSO47H2O的一种流程如图:

(1)步骤Ⅰ的操作是____________。
(2)步骤Ⅰ加入稀硫酸进行酸浸时,需不断通入高温水蒸气的目的是______________。
(3)步骤Ⅱ中,在pH约为5.1的滤液中加入高锰酸钾,生成Fe(OH)3和MnO(OH)2两种沉淀,该反应的离子方程式为____________________________________________。
(4)步骤Ⅲ中,加入锌粉的作用是______________。
(5)已知硫酸锌的溶解度与温度之间的关系如下表:
温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
溶解度/g | 41.8 | 54.1 | 70.4 | 74.8 | 67.2 | 60.5 |
从硫酸锌溶液中获得硫酸锌晶体的实验操作为________________、冷却结晶、过滤。烘干操作需在减压低温条件下进行,原因是_________________________________。
(6)取28.70 g ZnSO47H2O加热至不同温度,剩余固体的质量变化如图所示。分析数据,680℃时所得固体的化学式为______。

a.ZnO b.Zn3O(SO4)2 c.ZnSO4 d.ZnSO4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.明矾[KAl(SO4)2·12H2O] 在生产、生活中有广泛用途:饮用水的净化;造纸工业上作施胶剂;食品工业的发酵剂等。利用炼铝厂的废料——铝灰(含Al、 Al2O3及少量SiO2和FeO ·xFe2O3)可制备明矾。工艺流程如下:

已知生成氢氧化物沉淀的pH如下表所示:
Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
开始沉淀 | 3.4 | 6.3 | 1.5 |
完全沉淀 | 4.7 | 8.3 | 2.8 |
回答下列问题:
(1)明矾净水的原理是______________________________(用离子方程式表示)。
(2)操作Ⅱ是_______________、_________________、过滤、洗涤、干燥。
(3)检验滤液A中是否存在Fe2+的方法______________________________ (只用一种试剂)。
(4)在滤液A中加入高锰酸钾发生反应的离子方程式为:__________。
(5)调节pH=3的目的是_______________________ ,滤渣2含有的物质是______。
II.(6)取一定量含有Pb2+、Cu2+的工业废水,向其中滴加Na2S溶液,当PbS开始沉淀时,溶液中c(Pb2+)/c(Cu2+) =_________ (保留三位有效数字)。[已知Ksp(PbS)=3.4×10-28,
Ksp(CuS)=1.3×10-36]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表第四周期的8、9、10列元素为X、Y、Z,它们的化合物在生产生活中有着广泛的应用。回答下列问题(涉及的化学式用元素符号表示)
(1)基态X原子的价电子排布式为______________________,Z2+核外3d能级上有___________对成对电子。
(2)Y3+的一种配离子[Y(N3) (NH3)5]2+中,Y3+的配位数是___________,lmol配离子中所含σ键的数目为___________,配位体N3-中心原子杂化类型为______________________。
(3)Y2+在水溶液中以[Y(H2O)6]2+存在。向含Y2+的溶液中加入过量氨水可生成更稳定的[Y(NH3)6]2+,其原因是____________________________________________。
(4)X离子与KCN形成的蓝色晶体中,X2+、X3+分别占据立方体互不相邻的顶点,而立方体的每条棱上均有一个CN-,K+位于立方体的某恰当位置上。据此可知该晶体的化学式为______________________,立方体中X2+间连接起来形成的空间构型是____________________。
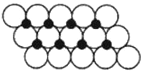
(5)一定温度下,ZO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Z2+填充其中(如图),已知O2-的半径为apm,每平方米面积上分散的该晶体的质量为___________g(用含a、NA的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com