


 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:
| A、金属阳离子一定只具有氧化性 |
| B、金属单质作反应物时一定不是氧化剂 |
| C、氧化还原反应中有一种元素被氧化时,一定有另一种元素被还原 |
| D、氧化还原反应中的反应物,不是氧化剂就是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、由130 56Ba 可推断其原子核外电子排布及元素的相对原子质量 |
| B、通过化学变化无法实现16O2与18O2间的相互转化 |
| C、Ca(HCO3)2、Fe(OH)3、FeCl2均可通过化合反应制得 |
| D、等物质的量KMnO4和MnO2分别与足量的浓盐酸反应,前者生成氯气体积大(标况) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
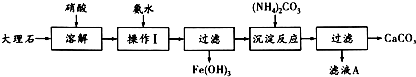
科目:高中化学 来源: 题型:
查看答案和解析>>
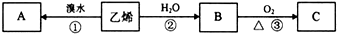
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
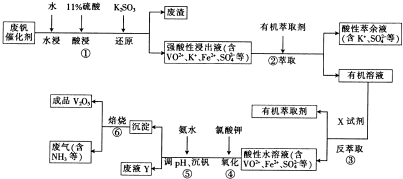
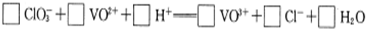
| pH | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| 钒沉淀率/% | 94.8 | 96.0 | 98.0 | 98.8 | 98.2 | 96.4 | 93.1 | 89.3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com